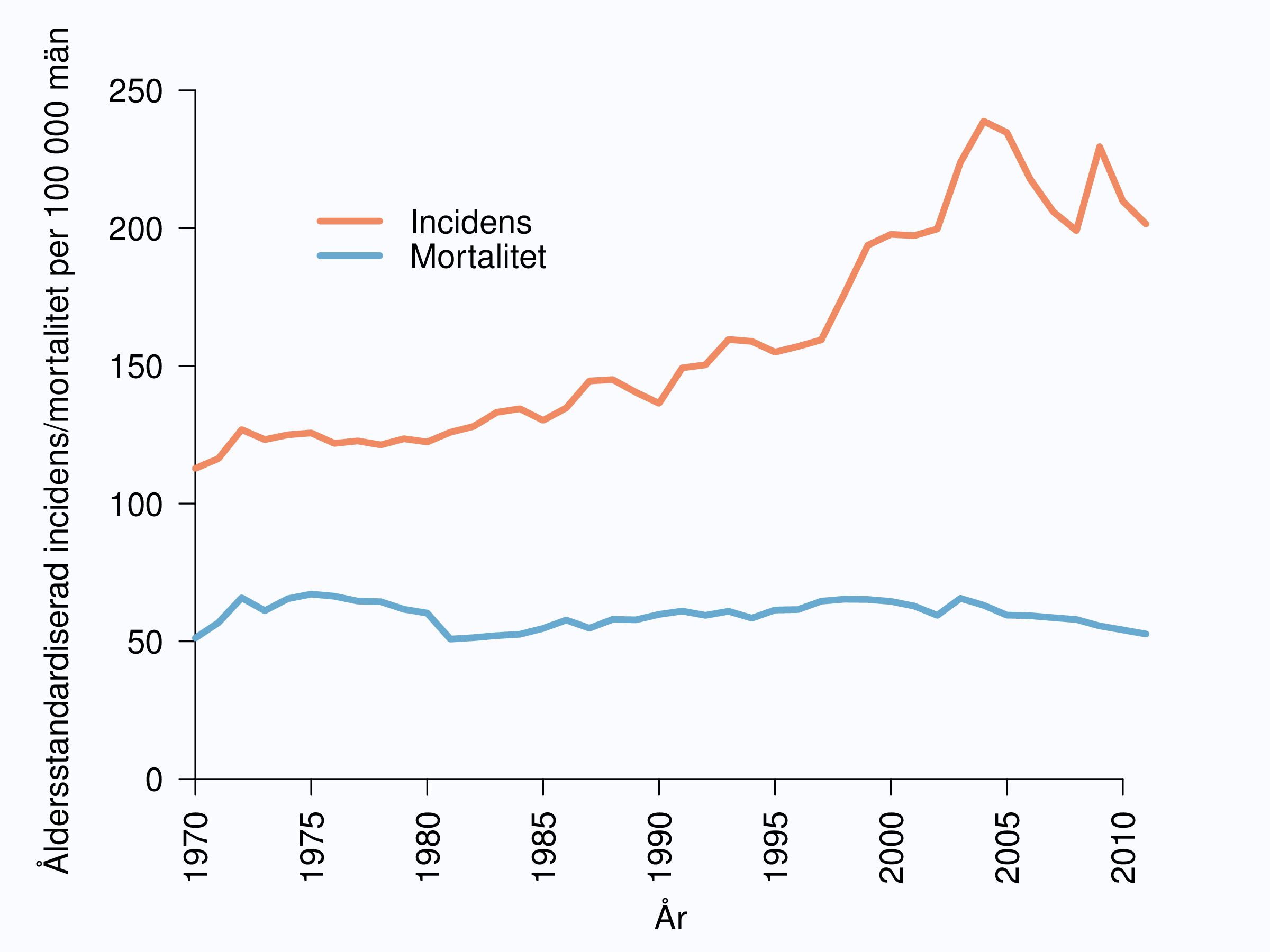
Åldersstandardiserad enligt befolkningen i Sverige (incidens) respektive Norden (mortalitet) år 2000. Källa: Socialstyrelsen (incidens), www.socialstyrelsen.se, respektive NORDCAN (mortalitet), www.ancr.nu.
I Nationella prostatacancerregistret (NPCR) registreras sedan 1998 nya fall av prostatacancer från
landets alla sex sjukvårdsregioner med en täckning som överskrider 98 % jämfört med
Cancerregistret, till vilket registreringen är lagstadgad. Nyheter i rapporteringen från NPCR under
2013 är att vi öppnat en publik hemsida; www.npcr.se, med information om registret och
tillgång till nationella och regionala årsrapporter. En arbetsgrupp från NPCR och INCA har
skapat en online-rapport i (nästan) realtid på INCA. För åtkomst till rapporten krävs
autentisering eftersom INCA innehåller integritetskänsliga data. I online-rapporten finns data som
redovisas på exakt samma vis som i årsrapporten. Rapporten visar data på nivåerna; den
egna kliniken, alla landsting samt riksgenomsnittet. Styrgruppens förhoppning är att detta
verktyg ska stimulera till snabbare inrapportering av data till NPCR, eftersom man nu
kan analysera den egna klinikens data direkt efter inrapportering. En viss fördröjning på
några veckor finns dock, eftersom data fortfarande monitoreras innan de läggs in i INCA.
21 november 2013
Pär Stattin, Fredrik Sandin, Ola Bratt, Camilla Thellenberg Karlsson, Ingela Frank-Lissbrant, Marie
Hjälm-Eriksson och Jan-Erik Damber för styrgruppen för Nationella prostatacancerregistret.
Fredrik Sandin, Regionalt cancercentrum Uppsala-Örebro, gjorde sammanställning och statistisk
bearbetning av data till årsrapporten.
Annette Wigertz, Regionalt cancercentrum Uppsala-Örebro, koordinerade, redigerade och
korrekturläste årsrapporten.
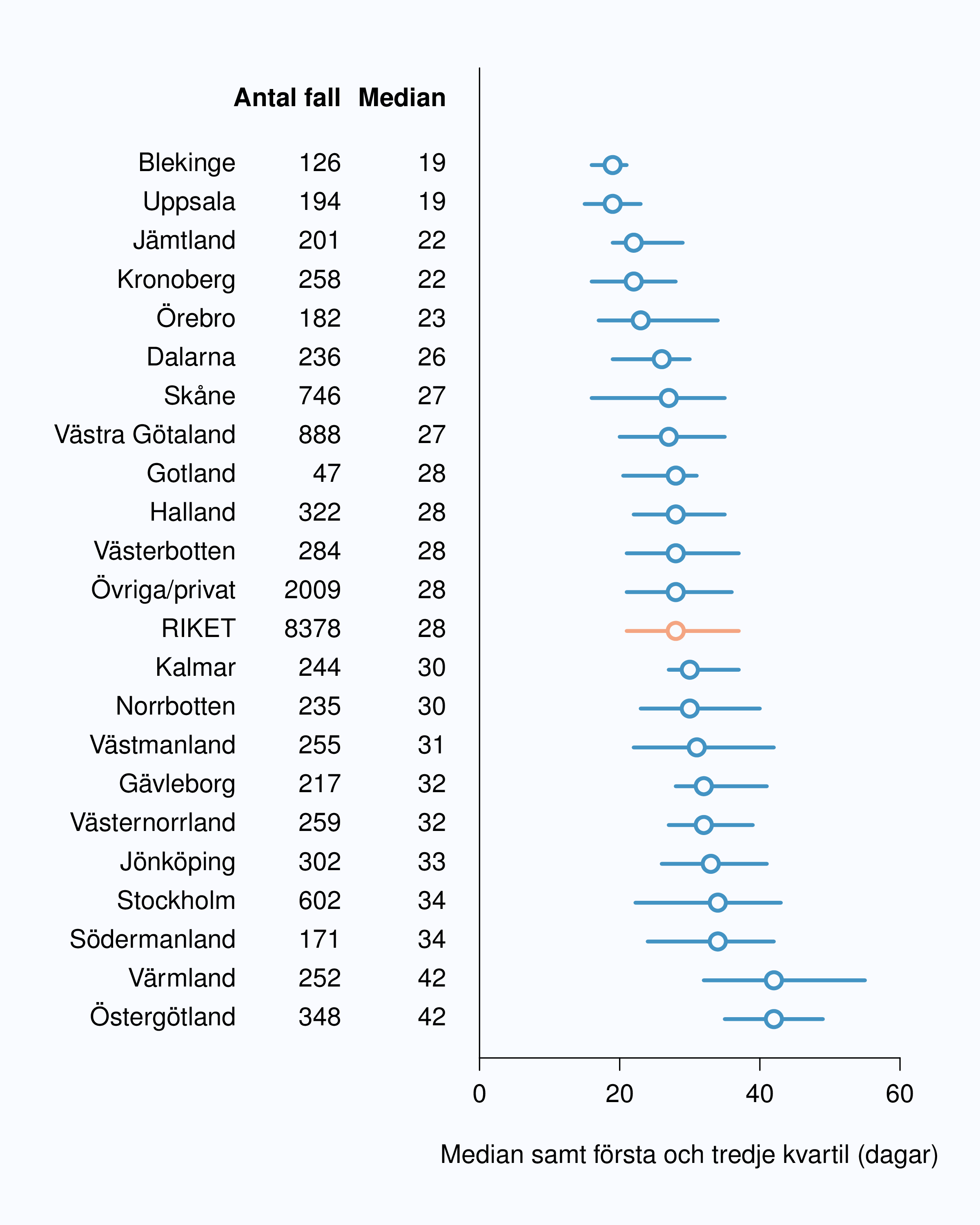
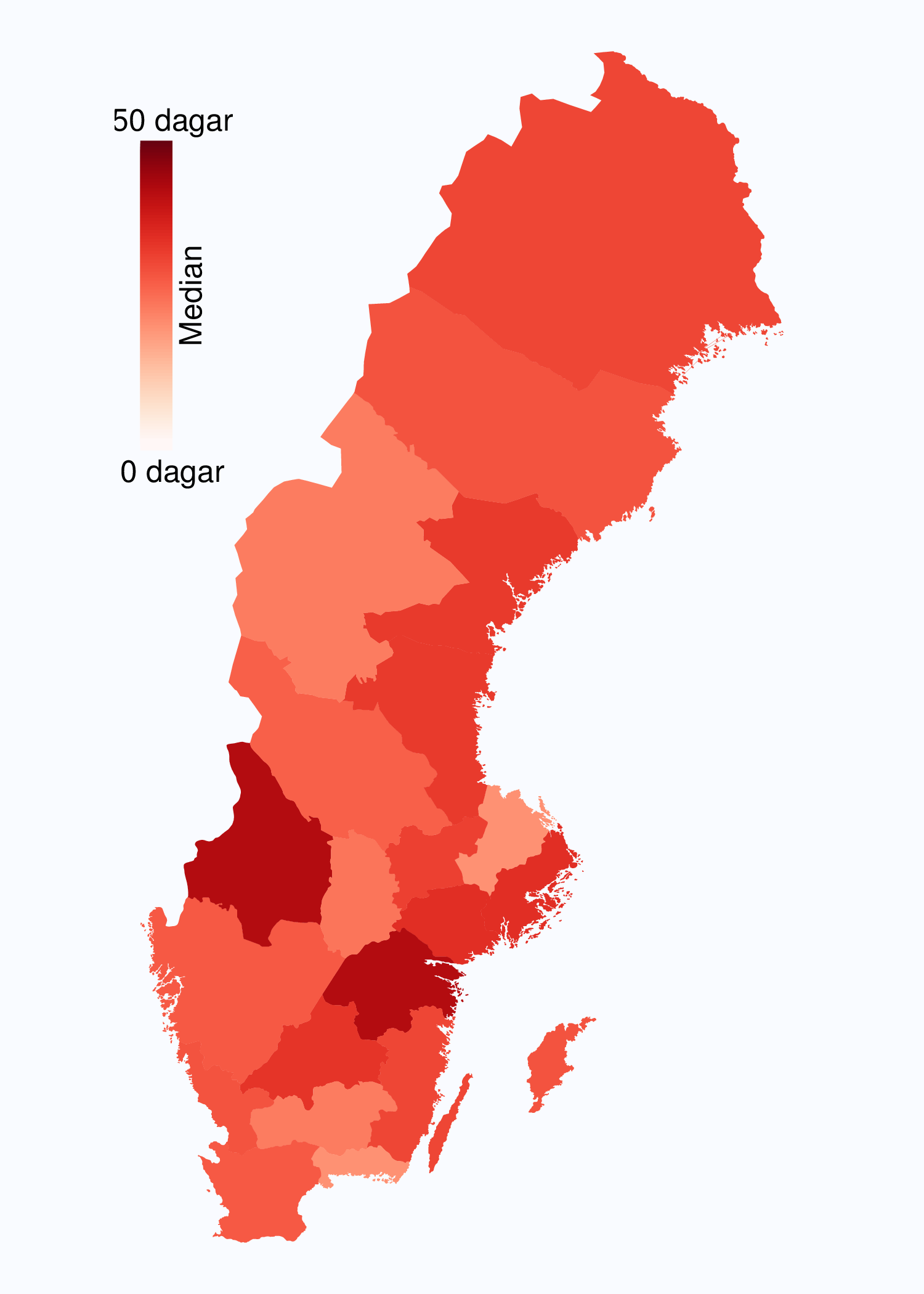
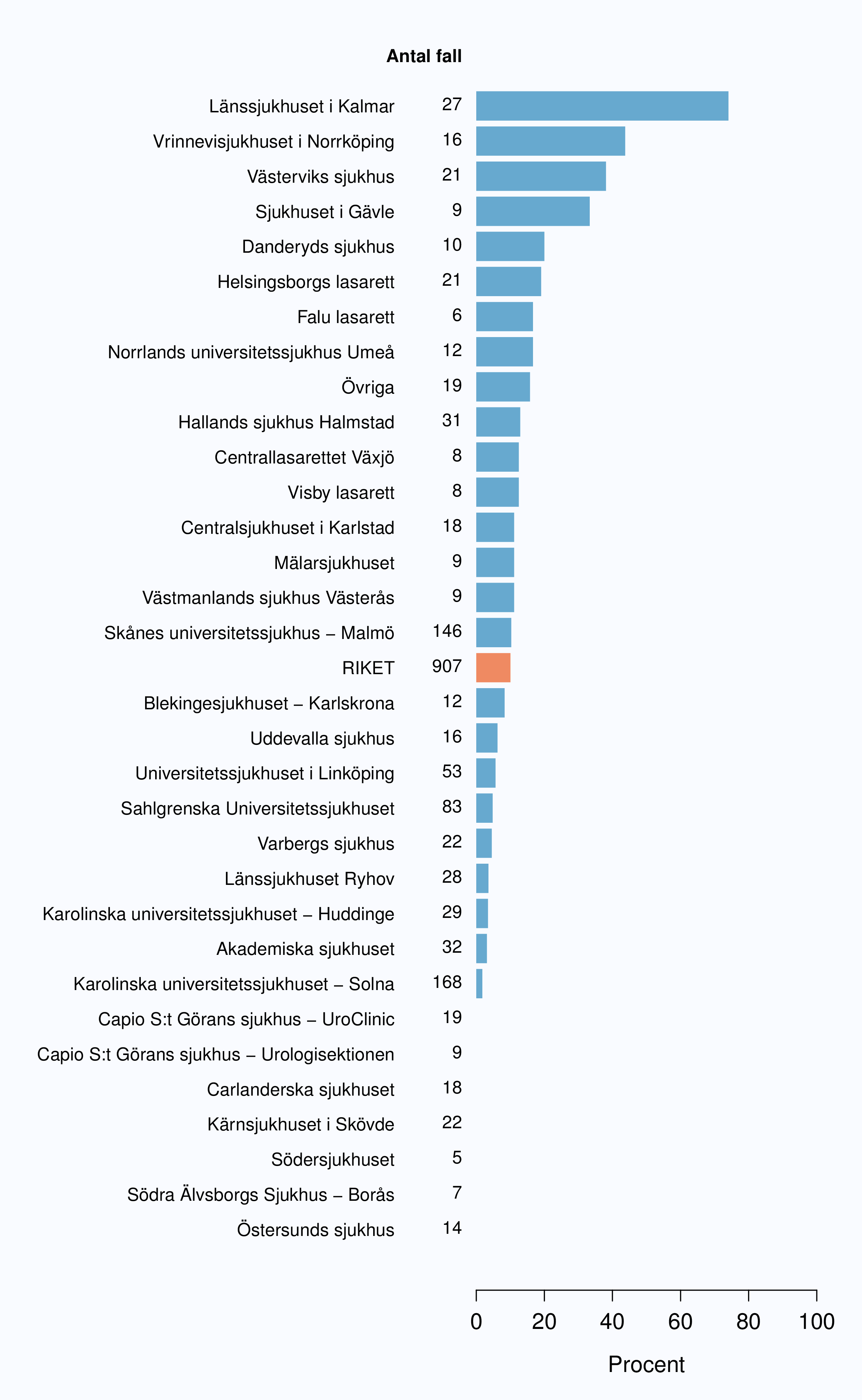
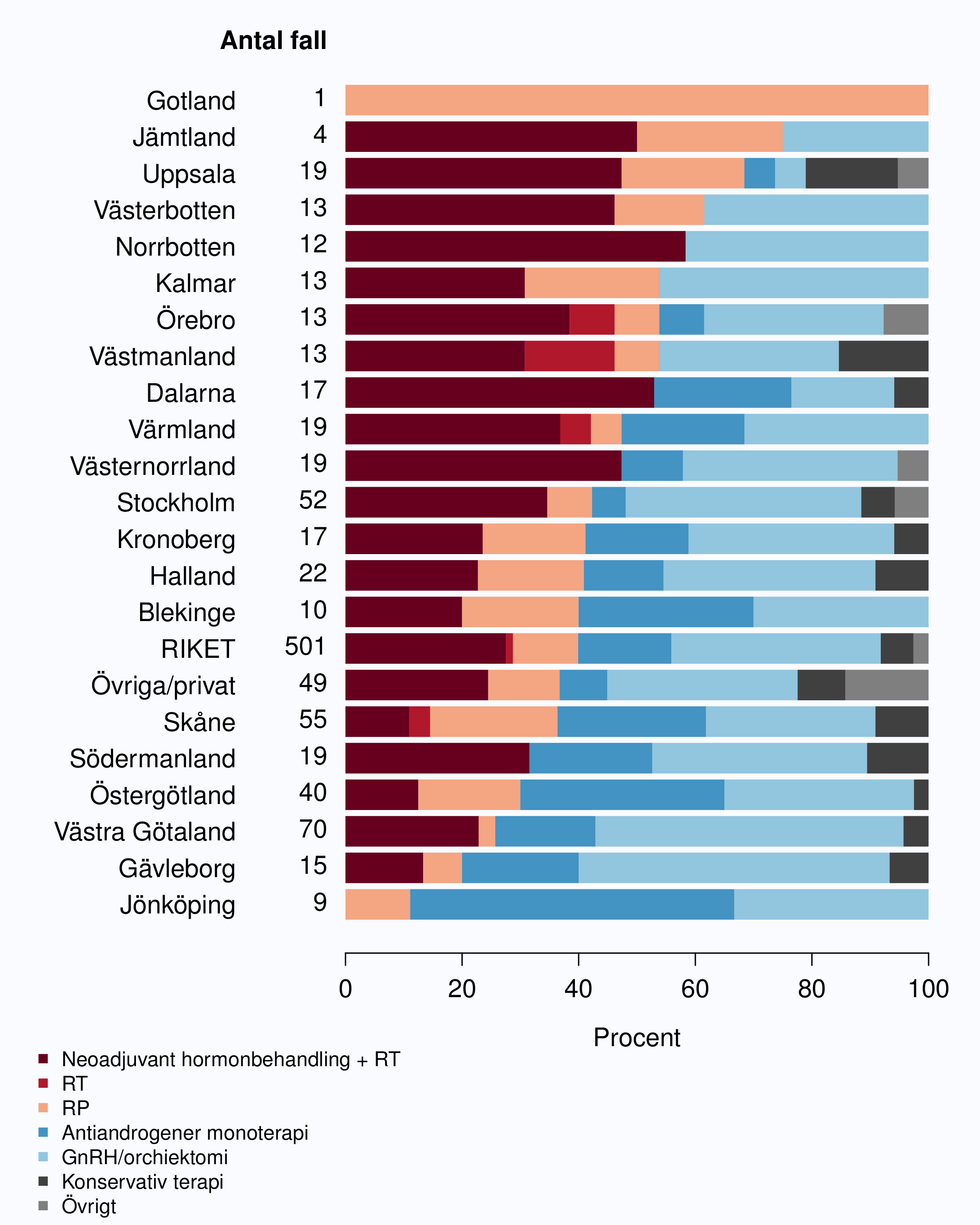
År 2010 infördes registrering av flera datum i vårdkedjan i NPCR för att kunna analysera väntetider för män med prostatacancer. Dessa data visar att väntetiderna överlag är långa för män med misstänkt eller diagnostiserad prostatacancer. Socialstyrelsen publicerade i oktober 2013 en utredning av väntetider i cancervården [1] och där noterades att NPCR var det enda register som registrerade datum för utfärdande av remiss (Figur 6 och 8). Tiden mellan cancerprov och besked om vad provet innehöll är den väntetid som patienter upplever som mest påfrestande. Medianvärdet för väntetiden mellan biopsitagning och cancerbesked till patienten var 2012 28 dagar i riket med en variation mellan 19 och 42 dagar mellan landsting med kortast och längst väntetid. NPCR har föreslagit en målnivå på högst 18 dagars väntetid mellan biopsi av prostata och PAD-besked. Jämfört med andra cancerformer är väntetiderna generellt långa för män med misstänkt eller diagnostiserad prostatacancer konstaterar NPCR och SoS utredare.
Lokalt avancerade tumörer har en hög risk att progrediera och cirka 30 % av män med lokalt
avancerade tumörer dör av prostatacancer inom tio år. År 2012 behandlades 67 % av män 75 år
eller yngre med lokalt avancerad prostatacancer i botande syfte. Dessa män bör i större
utsträckning erbjudas kurativ terapi och i NPCR anser vi att en rimlig målnivå är 90 %.
Andelen män 76-80 år med lokalt avancerad cancer som behandlades med kurativ terapi var
11 % . Eftersom den förväntade överlevnaden hos en 76-årig man idag är tio år och för en
80-årig man åtta år bör även en högre andel av dessa män genomgå kurativ terapi. Men mot
bakgrund av dagens svaga evidensläge är det svårt att motivera en exakt målnivå för denna
grupp av äldre män med lokalt avancerad cancer, här måste individuella ställningstaganden
göras eftersom samsjuklighet är en viktig faktor att ta hänsyn till i behandlingsbeslutet.
Antalet män som diagnostiseras med prostatacancer per år (incidensen) har ökat sedan registreringen i Cancerregistret startade 1958. En kraftigare ökning skedde från slutet av 1990-talet i samband med att mätning av prostata-specifikt antigen (PSA) blev allt mer vanligt, men denna ökning har nu planat ut. Dödligheten (mortaliteten) i prostatacancer har å andra sidan varit mer stabil och i princip helt oförändrad sedan 1970-talet (Figur 1).

Åldersstandardiserad enligt befolkningen i Sverige (incidens) respektive Norden (mortalitet) år 2000. Källa: Socialstyrelsen (incidens), www.socialstyrelsen.se, respektive NORDCAN (mortalitet), www.ancr.nu.
År 2012 diagnostiserades 8 719 fall av prostatacancer vilket innebär en minskning på 9 % jämfört med 2011. Täckningen var 96 % jämfört med Cancerregistret. För NPCR som helhet har vi sedan 1998 en mycket god täckning på 98 %, vilket innebär att data i NPCR är rikstäckande och populationsbaserade (Tabell 1). Täckningsgrad och antal patienter som diagnostiserades per landsting 2012 visas i tabell 2. Alla landsting, och även privata vårdgivare har en täckning jämfört med Cancerregistret på 87 % eller högre. Efterforskning på data fortsätter efter rapporten vilket innebär att vi kommer att uppnå cirka 98 % täckning även för 2012.
| |
Stockholm- |
Uppsala- |
Sydöstra |
Södra |
Västra |
Norra |
Totalt |
| Diagnosår | |||||||
| 1998 | 748 (69) | 1370 (98) | 716 (100) | 1154 (100) | 1376 (98) | 772 (100) | 6136 (94) |
| 1999 | 1140 (92) | 1580 (99) | 791 (100) | 1333 (99) | 1476 (99) | 835 (100) | 7155 (98) |
| 2000 | 1193 (84) | 1519 (100) | 776 (100) | 1412 (100) | 1578 (98) | 756 (100) | 7234 (96) |
| 2001 | 1285 (90) | 1587 (100) | 778 (100) | 1518 (100) | 1568 (98) | 712 (100) | 7448 (98) |
| 2002 | 1344 (86) | 1655 (100) | 853 (100) | 1482 (99) | 1459 (99) | 828 (100) | 7621 (97) |
| 2003 | 1702 (95) | 1909 (100) | 905 (100) | 1655 (100) | 1757 (99) | 927 (100) | 8855 (99) |
| 2004 | 1927 (95) | 2022 (99) | 1030 (100) | 1808 (100) | 1914 (99) | 1056 (100) | 9757 (99) |
| 2005 | 1973 (95) | 1979 (99) | 1145 (100) | 1794 (99) | 1883 (100) | 957 (100) | 9731 (99) |
| 2006 | 1683 (86) | 1917 (99) | 1126 (100) | 1716 (99) | 1895 (100) | 828 (100) | 9165 (97) |
| 2007 | 1676 (98) | 1828 (99) | 1099 (100) | 1630 (98) | 1801 (100) | 869 (100) | 8903 (99) |
| 2008 | 1611 (93) | 1829 (100) | 1049 (100) | 1729 (98) | 1702 (100) | 930 (100) | 8850 (98) |
| 2009 | 2014 (96) | 2250 (100) | 1397 (100) | 1876 (99) | 1947 (100) | 1028 (100) | 10512 (99) |
| 2010 | 1884 (98) | 1927 (100) | 1235 (100) | 1678 (98) | 1949 (100) | 1078 (100) | 9751 (99) |
| 2011 | 1786 (91) | 1955 (100) | 1209 (100) | 1786 (97) | 1849 (100) | 972 (100) | 9557 (98) |
| 2012 | 1746 (91) | 1716 (100) | 1116 (100) | 1588 (91) | 1539 (100) | 1014 (99) | 8719 (96) |
| Totalt | 23712 (91) | 27043 (99) | 15225 (100) | 24159 (98) | 25693 (99) | 13562 (100) | 129394 (98) |
Vi har undersökt patientkarakteristika, behandling och överlevnad för de män som registrerats i Cancerregistret men inte rapporterats till NPCR. Vi fann att 97.9 % återfanns i NPCR men att 2 598 av 103 047 (2.1 %) av män diagnostiserade med prostatacancer 1998-2009 enbart rapporterats till Cancerregistret. Med hjälp av data i Patientregistret, Läkemedelsregistret och Dödsorsaksregistret undersöktes ålder vid diagnos, primärbehandling, samsjuklighet och dödlighet i prostatacancer och andra orsaker. Män som inte fanns med i NPCR var i medeltal två år äldre vid diagnos, en mindre andel hade genomgått prostatektomi; 12 % vs 23 %, de icke-registrerade hade något kortare postoperativa vårdtider, medelvärde 4.1 vs 5.0 dagar och de hade en aning lägre total dödlighet efter 10 års uppföljning. Den i särklass starkaste faktorn för registrering var vårdgivare, andelen icke rapporterade fall varierade från 0.2 % till 7.5 % mellan landets landsting. Vi har vidare identifierat 1 932 män vars enda diagnosuppgift om prostatacancer kommer från Dödsorsaksregistret, s.k. ”death certificate only” diagnoser (DCO). Dessa män hade en medianålder på 85 år, och endast en enda man av dessa hade opererats med prostatektomi. De hade en mycket högre samsjuklighet än män registrerade i NPCR, och knappt hälften hade fått hormonbehandling före dödsdatum. Sammantaget talar dessa uppgifter för att NPCR är representativt för all prostatacancer i Sverige och att icke-rapporterade män som registrerats i Cancerregistret inte utgör någon speciell patientkategori och att den lilla grupp av män som diagnostiseras efter döden är en liten grupp av mycket gamla män med hög samsjuklighet och avancerad cancer vid diagnos.
| |
Cancer- |
NPCR |
Täcknings- |
| Landsting | |||
| Dalarna | 241 | 241 | (100) |
| Gotland | 48 | 48 | (100) |
| Halland | 330 | 330 | (100) |
| Jönköping | 309 | 309 | (100) |
| Kalmar | 245 | 245 | (100) |
| Kronoberg | 257 | 257 | (100) |
| Norrbotten | 241 | 241 | (100) |
| Värmland | 252 | 252 | (100) |
| Västmanland | 261 | 261 | (100) |
| Örebro | 194 | 194 | (100) |
| Östergötland | 360 | 360 | (100) |
| Västra Götaland | 931 | 930 | (100) |
| Uppsala | 226 | 225 | (100) |
| Jämtland | 202 | 201 | (100) |
| Södermanland | 183 | 182 | (99) |
| Västerbotten | 297 | 295 | (99) |
| Västernorrland | 263 | 261 | (99) |
| Gävleborg | 228 | 225 | (99) |
| Blekinge | 135 | 132 | (98) |
| Stockholm | 683 | 667 | (98) |
| Övriga/privat | 2271 | 2059 | (91) |
| Skåne | 882 | 765 | (87) |
Eftersom diagnosår är taget från Cancerregistret stämmer inte det totala antalet till fullo med antalet i tidigare tabell.
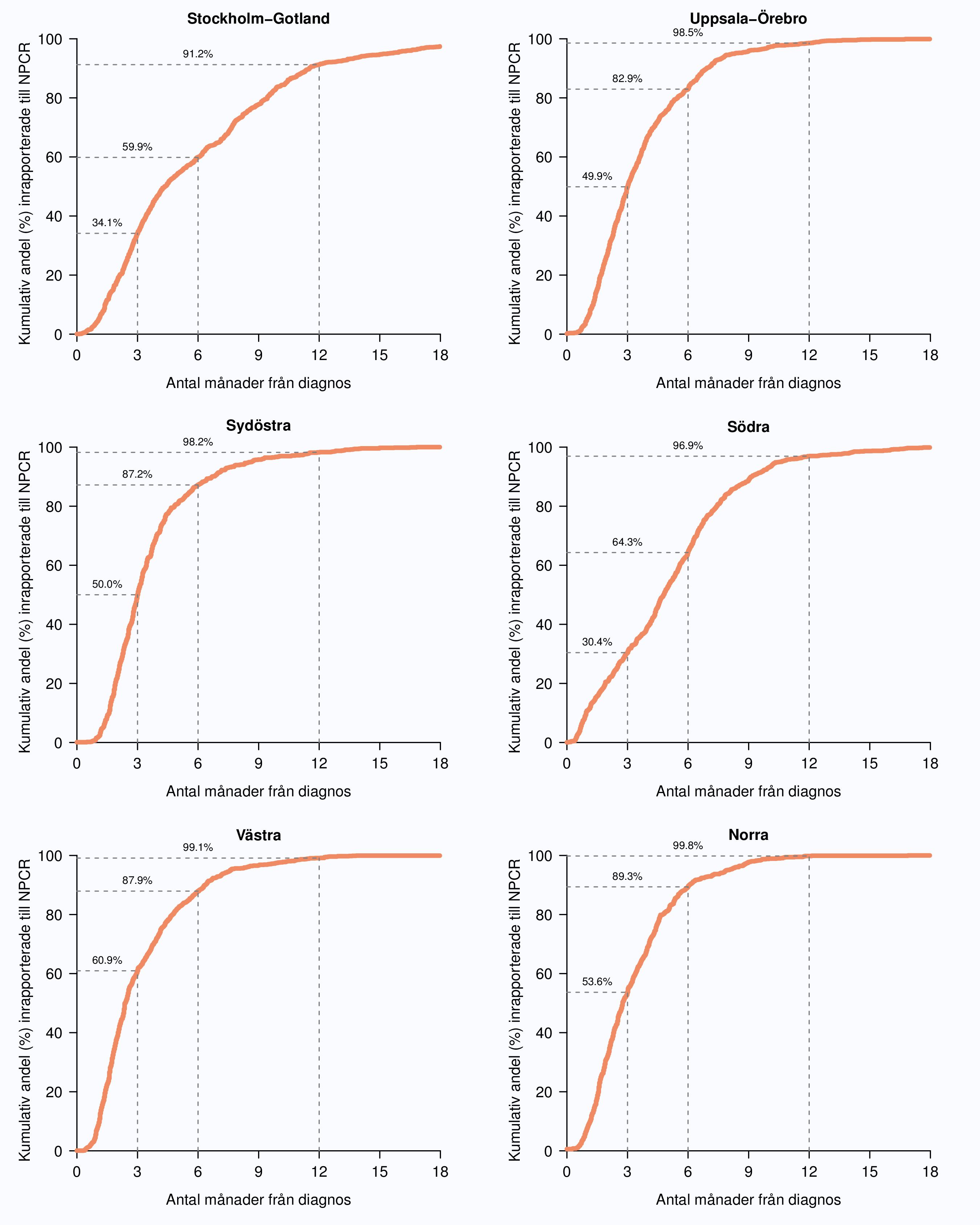
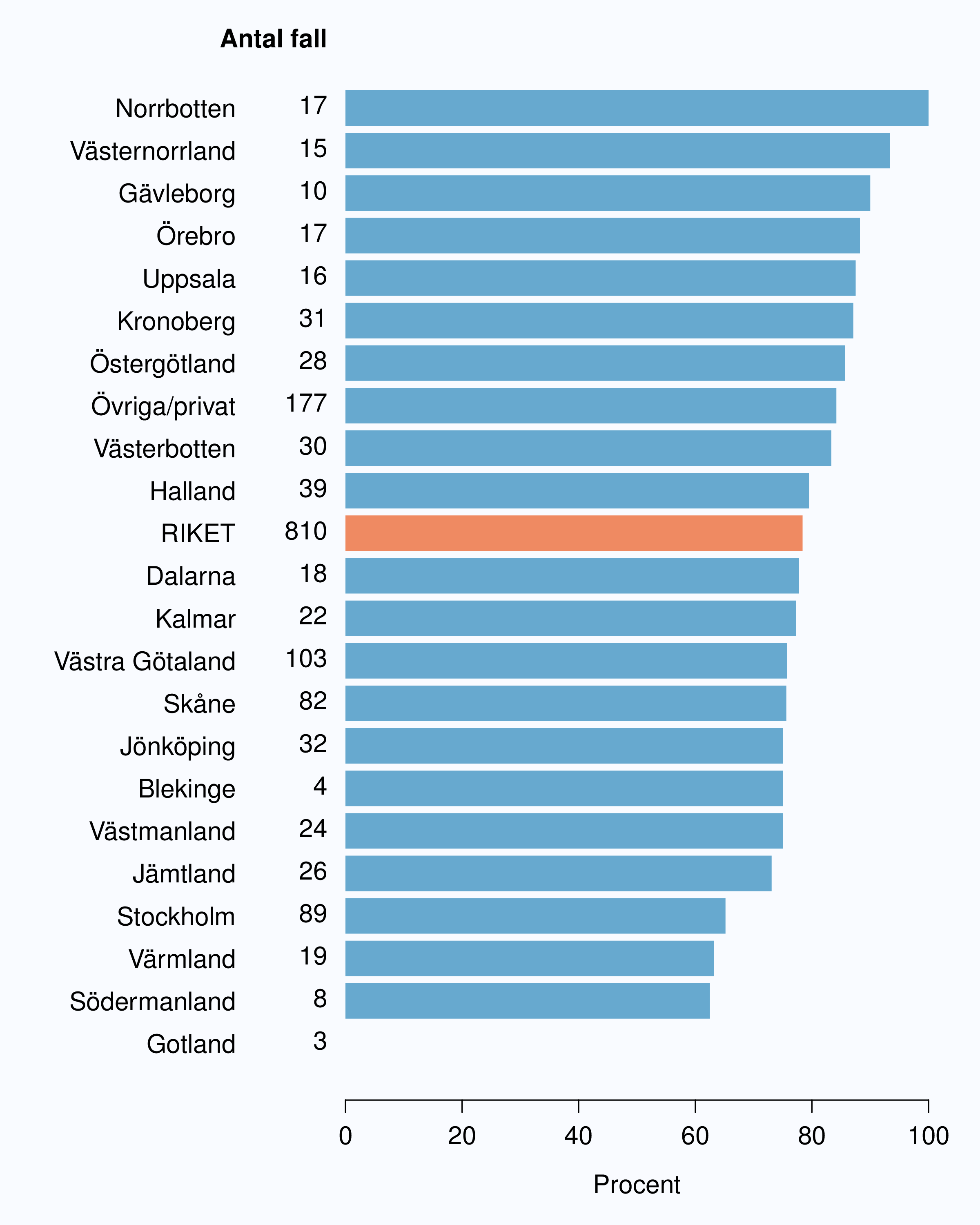
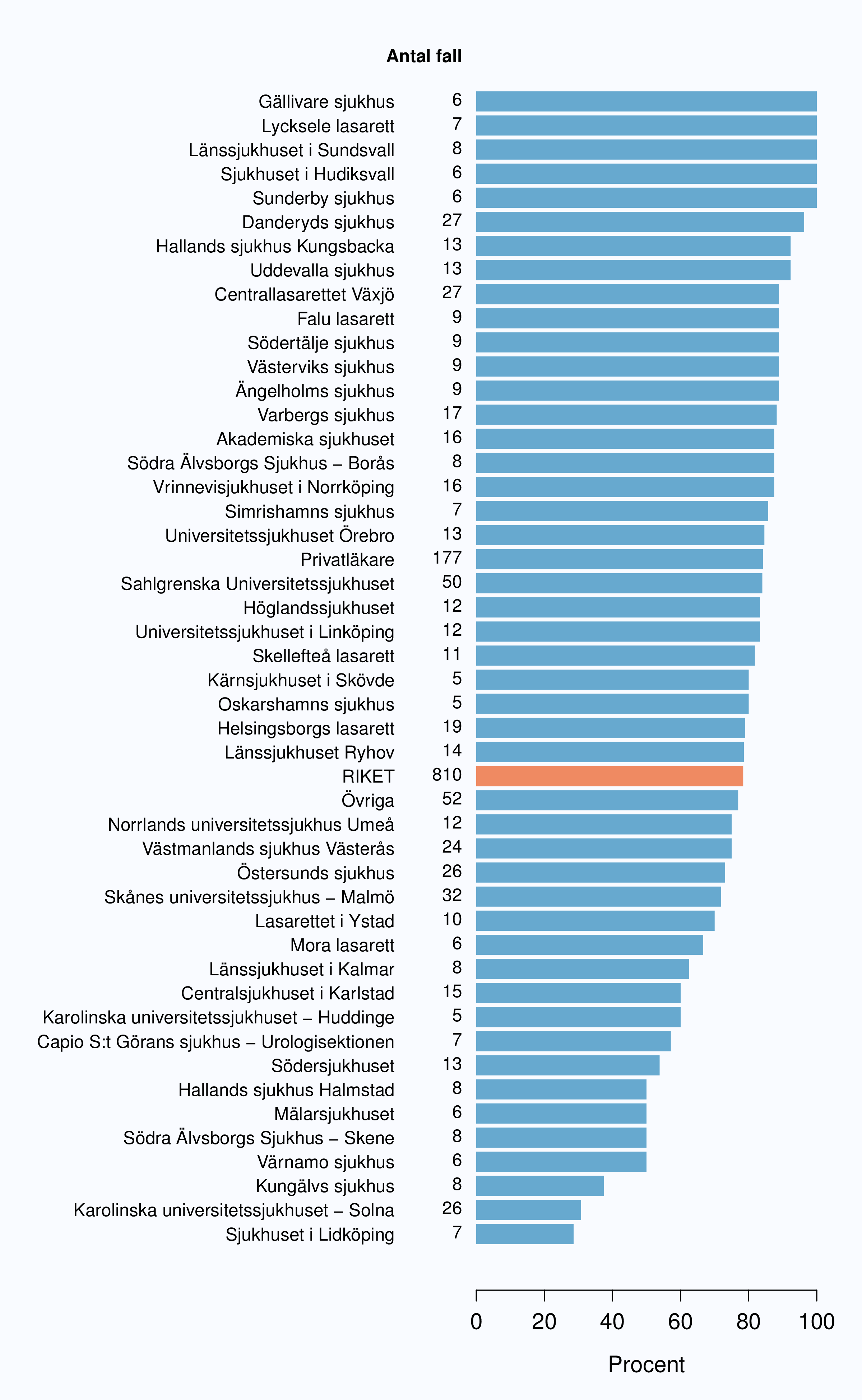
Figur 2 visar inrapporteringshastigheten i riket baserad på tiden mellan det datum då patienten fick diagnos och det datum då monitor rapporterade in data till INCA. Tre månader efter diagnos hade 46 % av män diagnostiserade under 2012 med prostatacancer inrapporterats till NPCR med en spridning mellan 34 % och 61 %. Tolv månader efter diagnosdatum hade 97 % av fallen rapporterats in till NPCR och andelen varierade från 91 % till 100 % mellan regionerna (Figur 2 och 3).
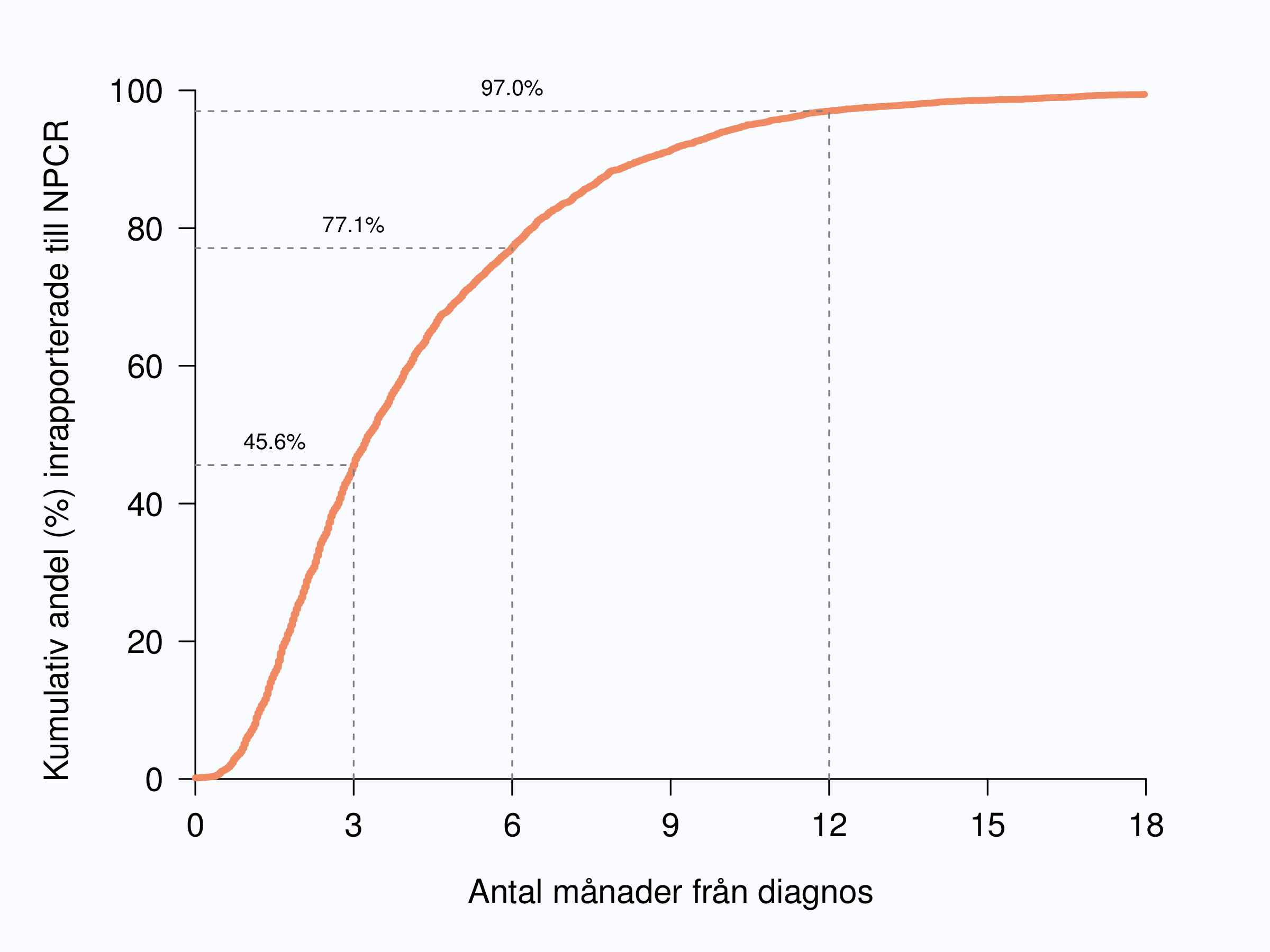
Den långa tiden mellan diagnos och inrapportering beror rimligen på att många vårdgivare inväntar påminnelse från sitt Regionala cancercentrum innan man rapporterar in data. I NPCR har vi satt som mål att diagnosformulär ska vara inrapporterad till INCA en månad efter att patienten fått sitt cancerbesked. Styrgruppen arbetar för att påskynda inrapporteringen eftersom en snabbare rapportering skulle medföra en rad fördelar, bland annat att inrapporterande enheter kan använda sina data i realtid, även i ett kortsiktigt kvalitetsarbete t.ex. för att korta väntetider. I syfte att förenkla och skynda på registreringen av data på diagnostikformuläret har information från kompletterande radiologiska undersökningar flyttats till primärbehandlingsformuläret. Ändrade rutiner på klinikerna med spontaninrapportering direkt efter PAD-besked skulle då göra det möjligt att nå målet om en månad från PAD-besked till registrering. I oktober 2013 lanserades en online-rapport i (nästan) realtid som gör att klinikern snabbt kan se den egna klinikens data i jämförelse med andra landsting och riksgenomsnittet. Förhoppningen är att detta verktyg stimulerar till snabbare inrapportering av data eftersom man nu kan analysera den egna klinikens data direkt efter inrapportering.
Prostatacancer är en sjukdom med en stor spridning av risken för död i sjukdomen. Den klassifikation
av riskkategorier som används i NPCR är en modifikation av National Comprehensive Cancer
Network [2]. Den baseras på lokalt kliniskt tumörstadium, eventuell förekomst av lymfkörtelmetastaser
och skelettmetastaser, Gleasonsumma på diagnostisk biopsi och PSA-nivå i serum vid datum för
diagnos. Denna klassifikation är starkt prognostisk vilket också har visats i NPCR [3]. Vi har justerat
klassifikationen så att vi särskiljer mellan lågt differentierade men lokaliserad cancer, dvs.
Gleasonsumma 8-10 och cT2 och lokalt avancerad cancer cT3 och/eller PSA mellan 20-50 μg/L.
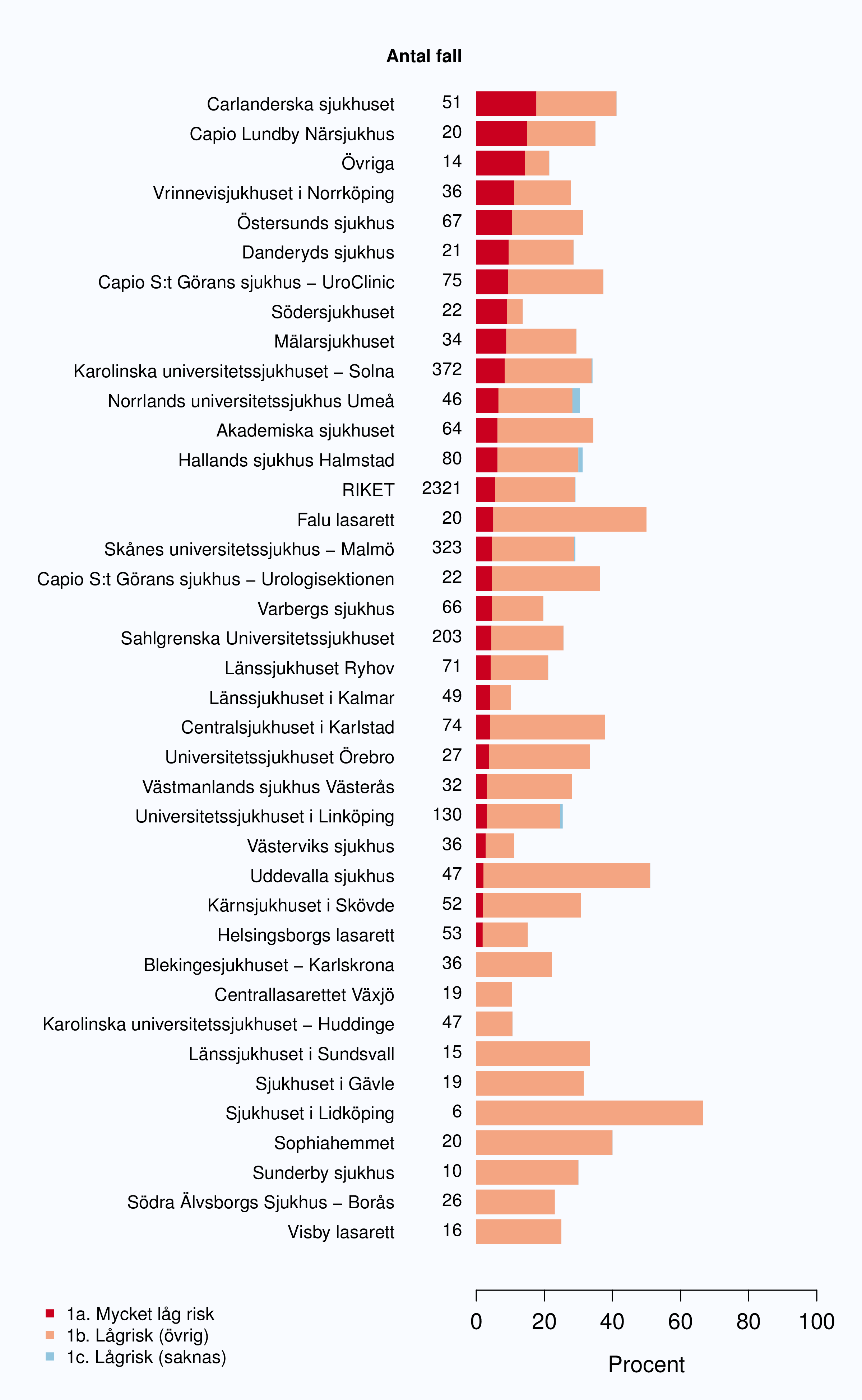
Det har skett en stark ökning av lokaliserad låg- och intermediärrisk cancer under de fjorton år som
NPCR samlat data (Figur 4, 5 och tabell 3). Skälet till denna ökning är framförallt en ökad
användning av PSA-testet, som i huvudsak leder till diagnos av låg risk cancer. Under samma
tidsperiod har andelen patienter med metastaser minskat. I absoluta antal har antalet diagnostiserade
lokaliserade cancerfall ökat mer än vad avancerade och metastaserad cancer minskat, vilket betyder att
en stor del av det ökade antalet fall som diagnostiserats under det senaste decenniet är ett nytillskott
som tidigare inte upptäcktes.
Tabell 3 redovisar fördelning av antal fall och andel per diagnosår och riskkategori.
| 1. Lågrisk |
| 1a. Mycket låg risk |
| 1b. Lågrisk (övrig) |
| 1c. Lågrisk (saknas) |
| 2. Intermediärrisk |
| 3a. Lokaliserad högrisk |
| 3b. Lokalt avancerad |
| 4. Regionalt metastaserad |
| 5. Fjärrmetastaserad |
| 6. Uppgift saknas |
| T1a |
| T1b |
| T1c |
| T2 |
| T3 |
| T4 |
| N1 |
| M1 |
| |
1. Lågrisk |
1a. Mycket |
1b. Lågrisk |
1c. Lågrisk |
2. Intermediär- |
3a. Lokaliserad |
3b. Lokalt |
4. Regionalt |
5. Fjärr- |
6. Uppgift |
| Diagnosår | ||||||||||
| 1998 | 844 (14) | 1057 (17) | 165 (3) | 1618 (26) | 713 (12) | 1557 (25) | 182 (3) | |||
| 1999 | 1098 (15) | 1376 (19) | 237 (3) | 1854 (26) | 809 (11) | 1565 (22) | 216 (3) | |||
| 2000 | 1310 (18) | 1430 (20) | 256 (4) | 1805 (25) | 743 (10) | 1495 (21) | 195 (3) | |||
| 2001 | 1593 (21) | 1512 (20) | 225 (3) | 1780 (24) | 750 (10) | 1376 (18) | 212 (3) | |||
| 2002 | 1765 (23) | 1605 (21) | 260 (3) | 1754 (23) | 705 (9) | 1373 (18) | 159 (2) | |||
| 2003 | 2113 (24) | 2103 (24) | 346 (4) | 1931 (22) | 767 (9) | 1401 (16) | 194 (2) | |||
| 2004 | 2789 (29) | 2291 (23) | 355 (4) | 2053 (21) | 761 (8) | 1284 (13) | 224 (2) | |||
| 2005 | 2797 (29) | 2367 (24) | 457 (5) | 1991 (20) | 721 (7) | 1206 (12) | 192 (2) | |||
| 2006 | 2645 (29) | 2286 (25) | 413 (5) | 1711 (19) | 699 (8) | 1118 (12) | 293 (3) | |||
| 2007 | 2593 (29) | 2337 (26) | 389 (4) | 1647 (18) | 647 (7) | 1076 (12) | 214 (2) | |||
| 2008 | 2497 (28) | 2433 (27) | 474 (5) | 1576 (18) | 555 (6) | 1083 (12) | 232 (3) | |||
| 2009 | 2984 (28) | 845 (8) | 1955 (19) | 184 (2) | 3123 (30) | 584 (6) | 1782 (17) | 587 (6) | 1174 (11) | 278 (3) |
| 2010 | 2750 (28) | 942 (10) | 1718 (18) | 90 (1) | 2951 (30) | 589 (6) | 1593 (16) | 547 (6) | 1082 (11) | 239 (2) |
| 2011 | 2679 (28) | 905 (9) | 1712 (18) | 62 (1) | 3019 (32) | 598 (6) | 1481 (15) | 507 (5) | 1030 (11) | 243 (3) |
| 2012 | 2349 (27) | 872 (10) | 1446 (17) | 31 (0) | 2700 (31) | 557 (6) | 1293 (15) | 474 (5) | 1102 (13) | 244 (3) |
Definitioner av riskkategorier, baserat på klinisk bedömning, dvs. palpation av prostata, tumördifferentiering enligt Gleason i biopsier, samt PSA-nivå vid diagnos.
| 1. Lågrisk | 1a. Mycket låg risk |
| 1b. Lågrisk (övrig) | 1c. Lågrisk (saknas) |
| 2. Intermediärrisk | 3a. Lokaliserad högrisk |
| 3b. Lokalt avancerad | 4. Regionalt metastaserad |
| 5. Fjärrmetastaserad | 6. Uppgift saknas |
Patienter med misstänkt prostatacancer utreds och diagnostiseras på urologiska specialistmottagningar
och på vissa orter på allmänkirurgiska mottagningar. Sedan 2009 redovisas väntetid mellan datum för
utfärdande av remiss på grund av misstänkt prostatacancer och datum för första besök på
specialistmottagning. Överlag fortsätter väntetiderna att vara långa och inga större förändringar har
skett sedan 2009.
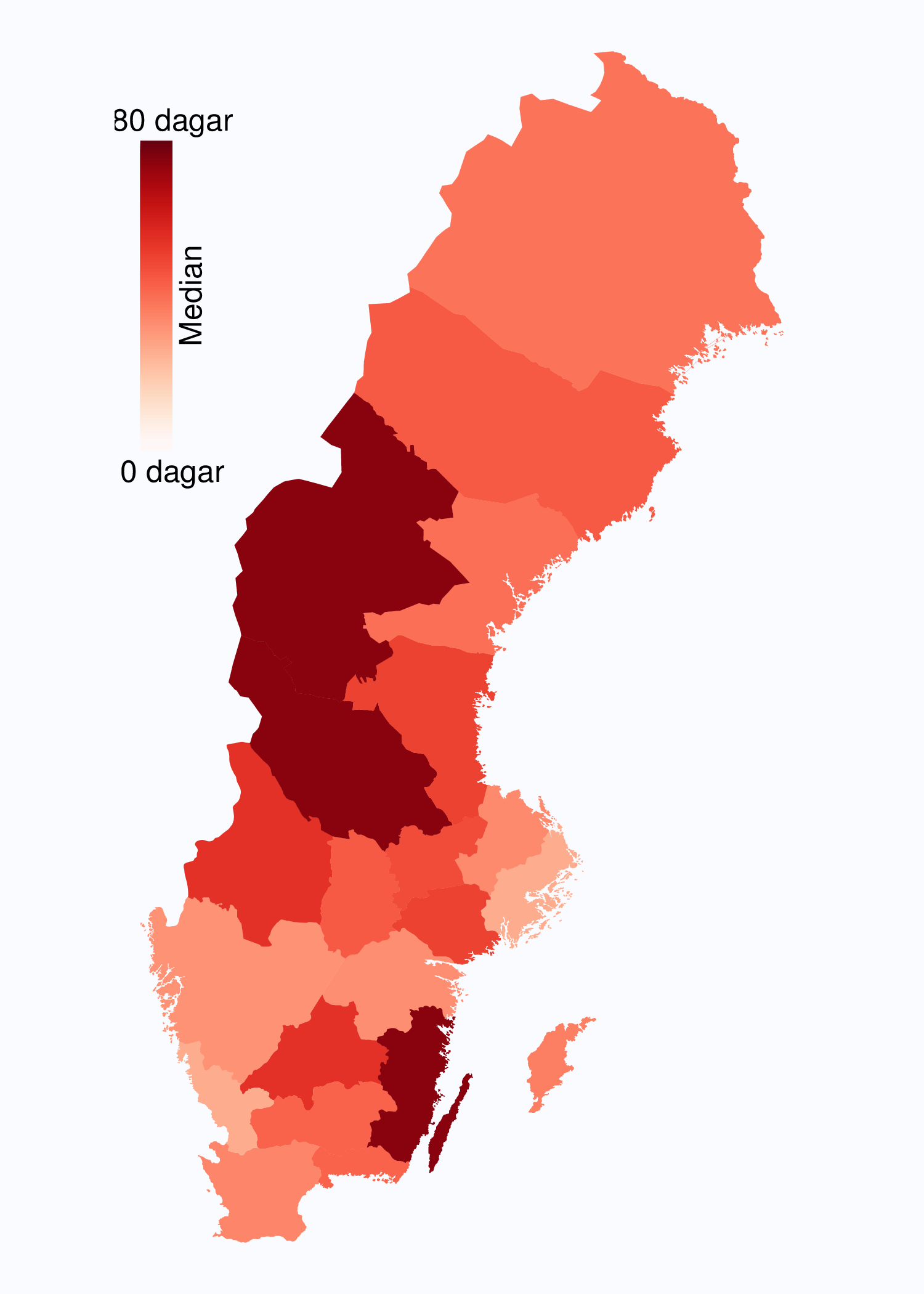
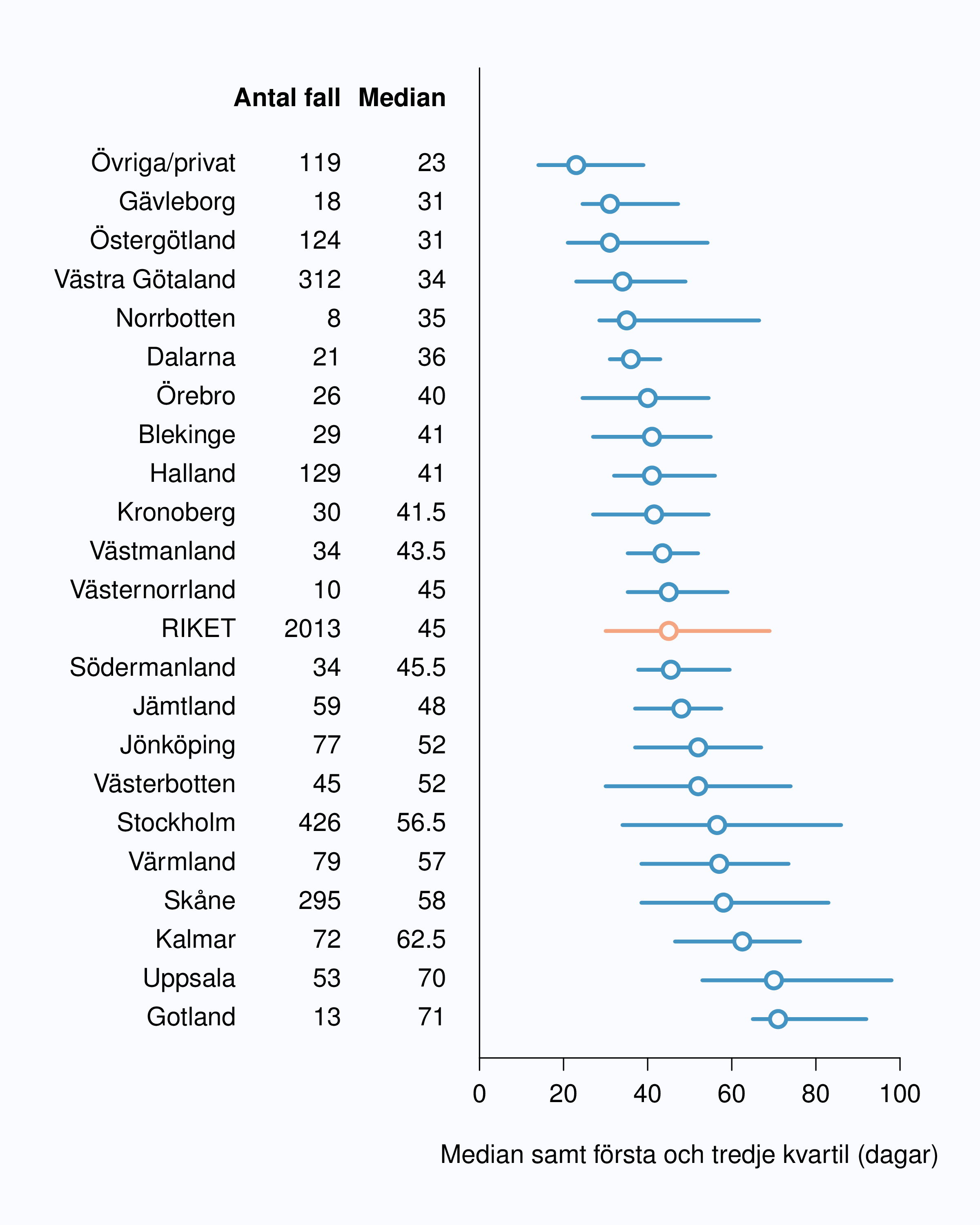
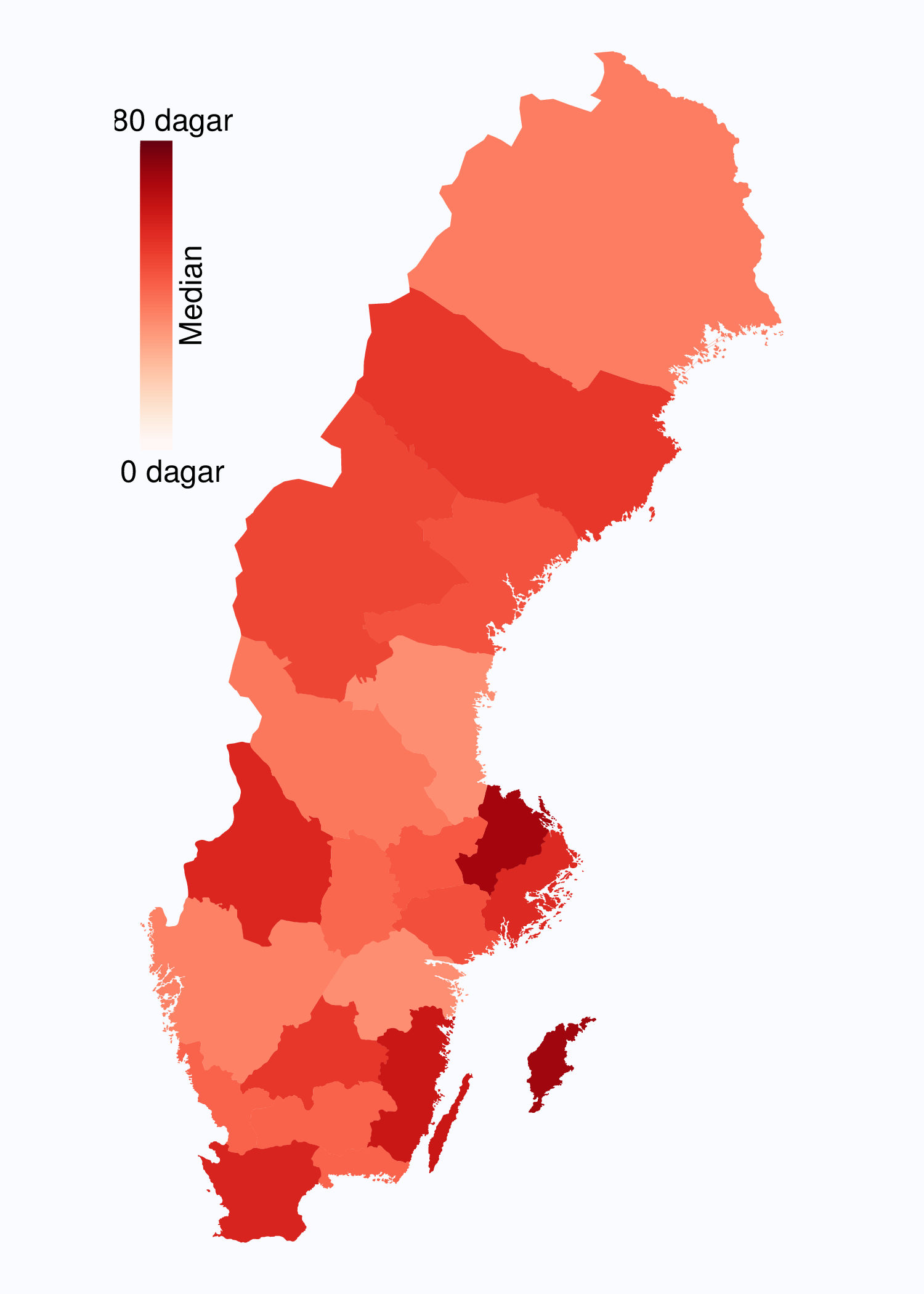
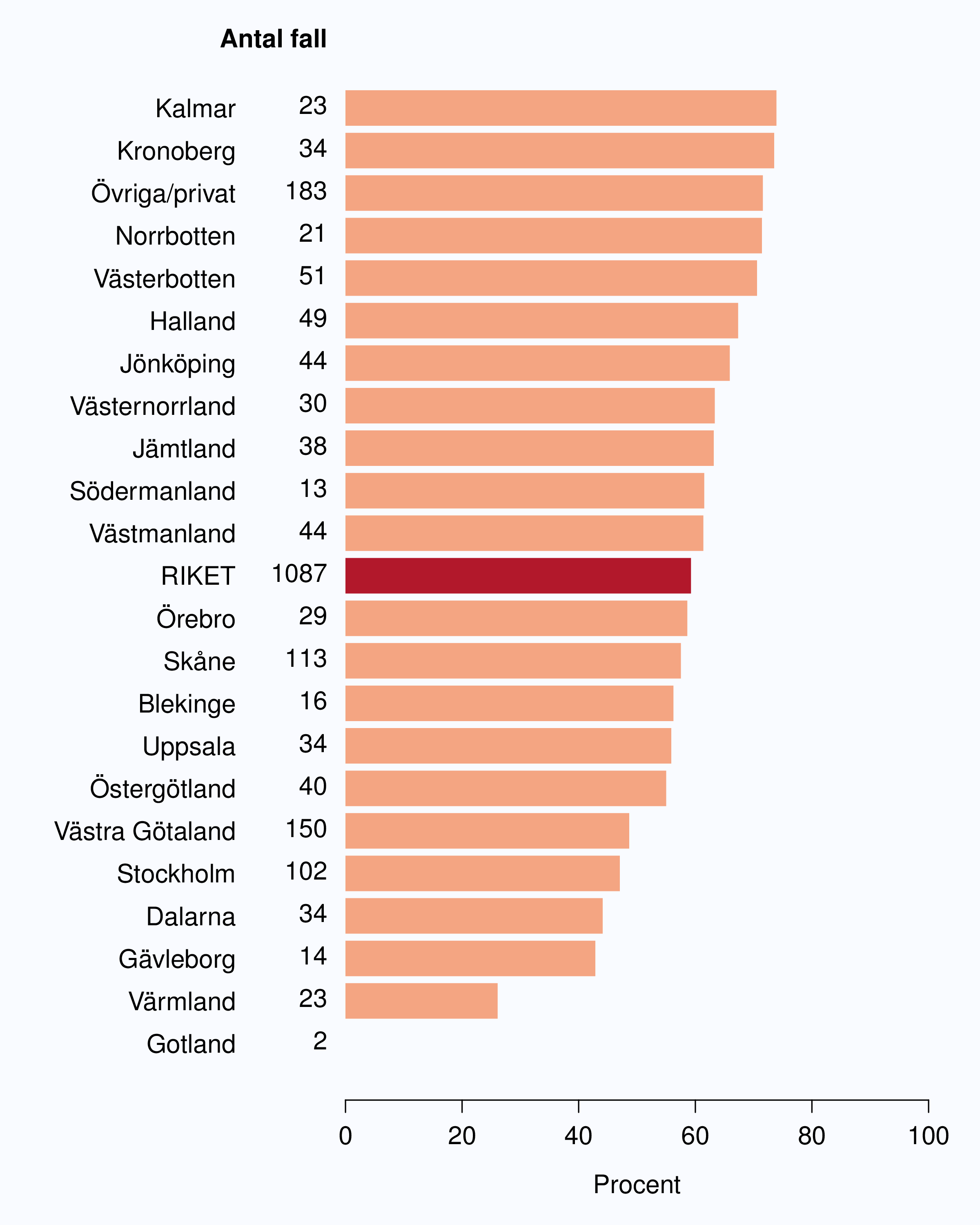
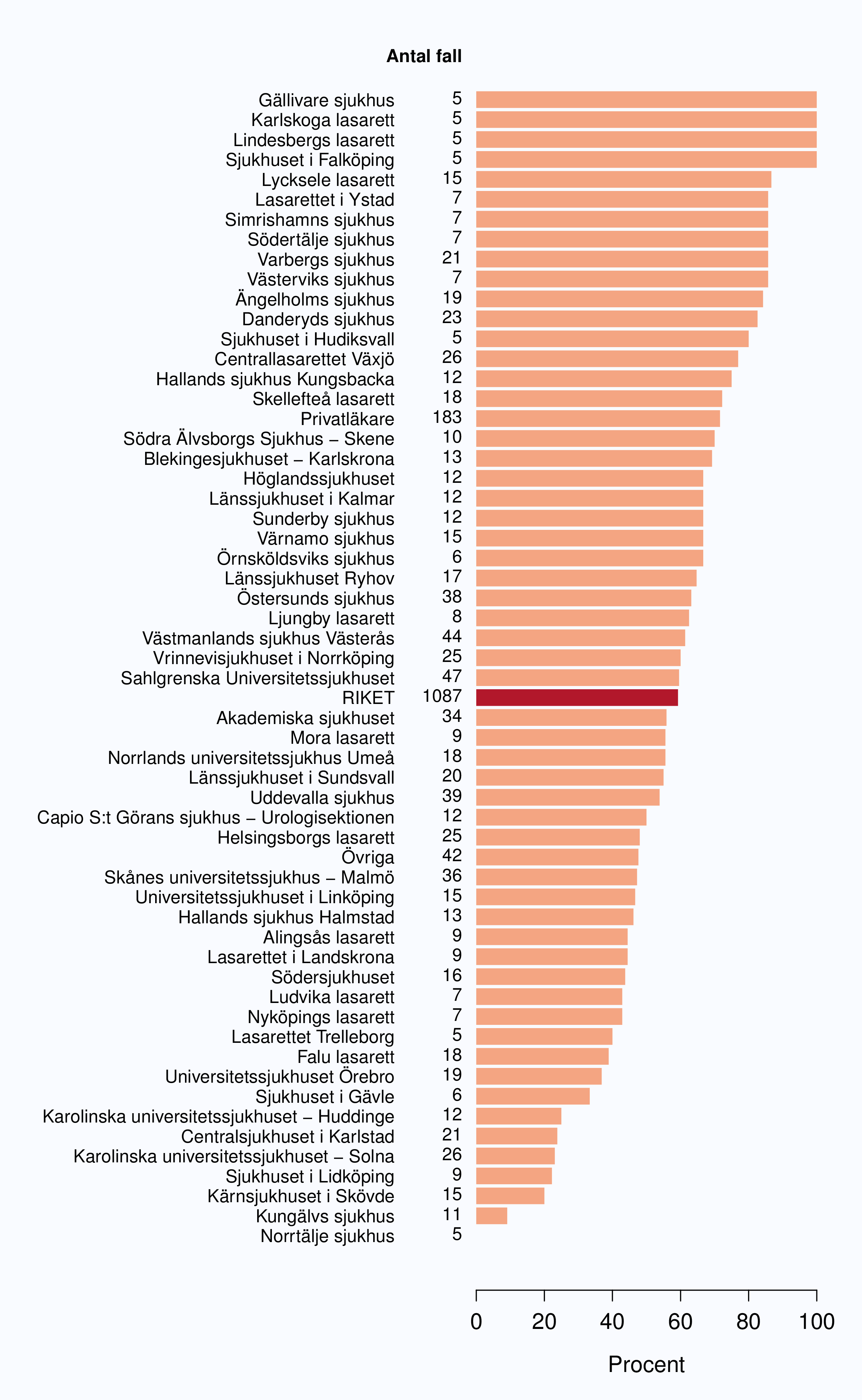
I figur 6 visas medianväntetiden i dagar för alla landsting år 2012. I riket var medianväntetiden från
remiss till första besök på mottagning 35 dagar med en spridning mellan 24 och 75 dagar
mellan landstingen, vilket är en liten förbättring jämfört med 2011. I figur 8 redovisas
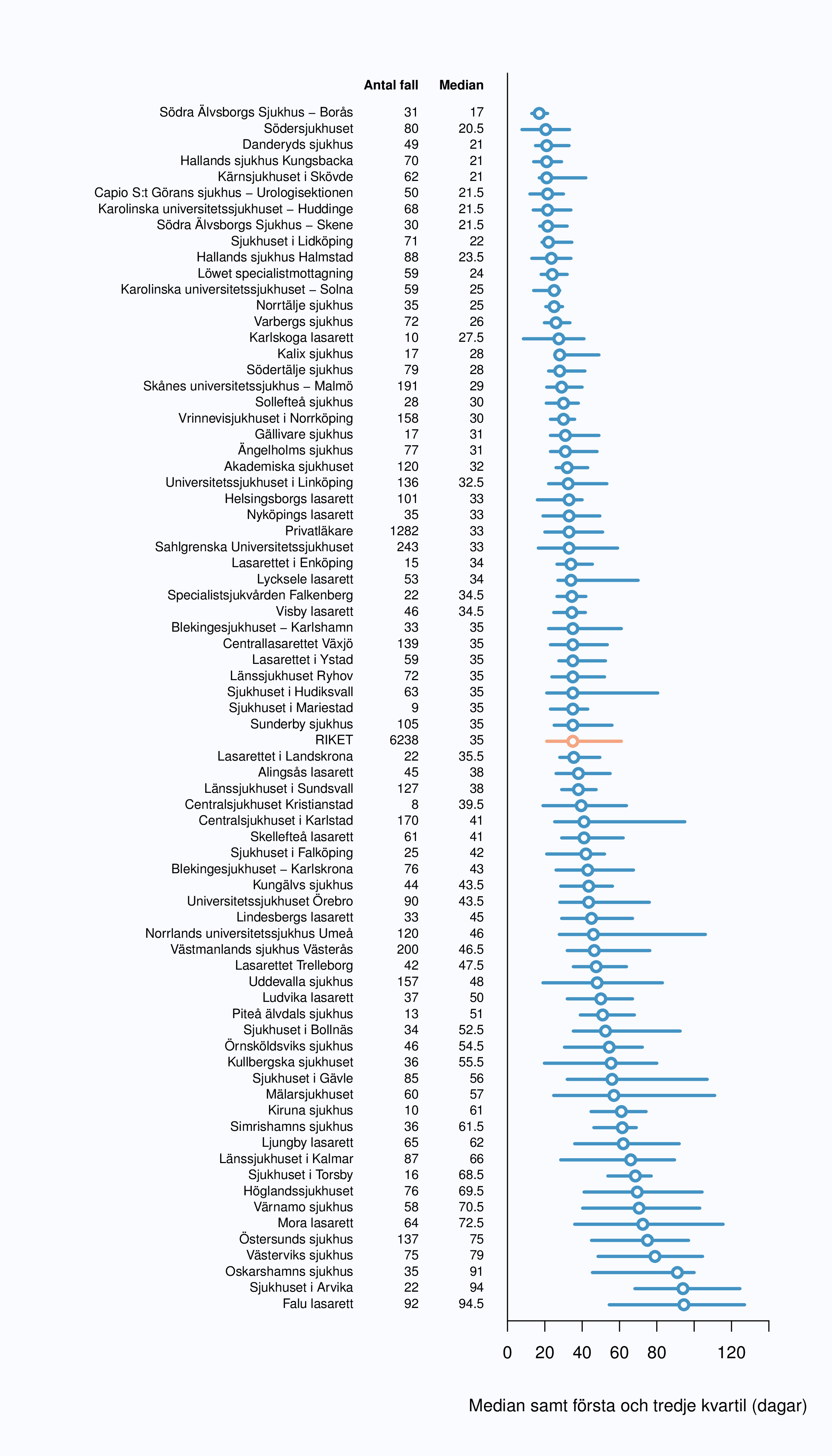
väntetider per sjukhus för år 2012; tre sjukhus hade medianväntetider överskridande 90
dagar.
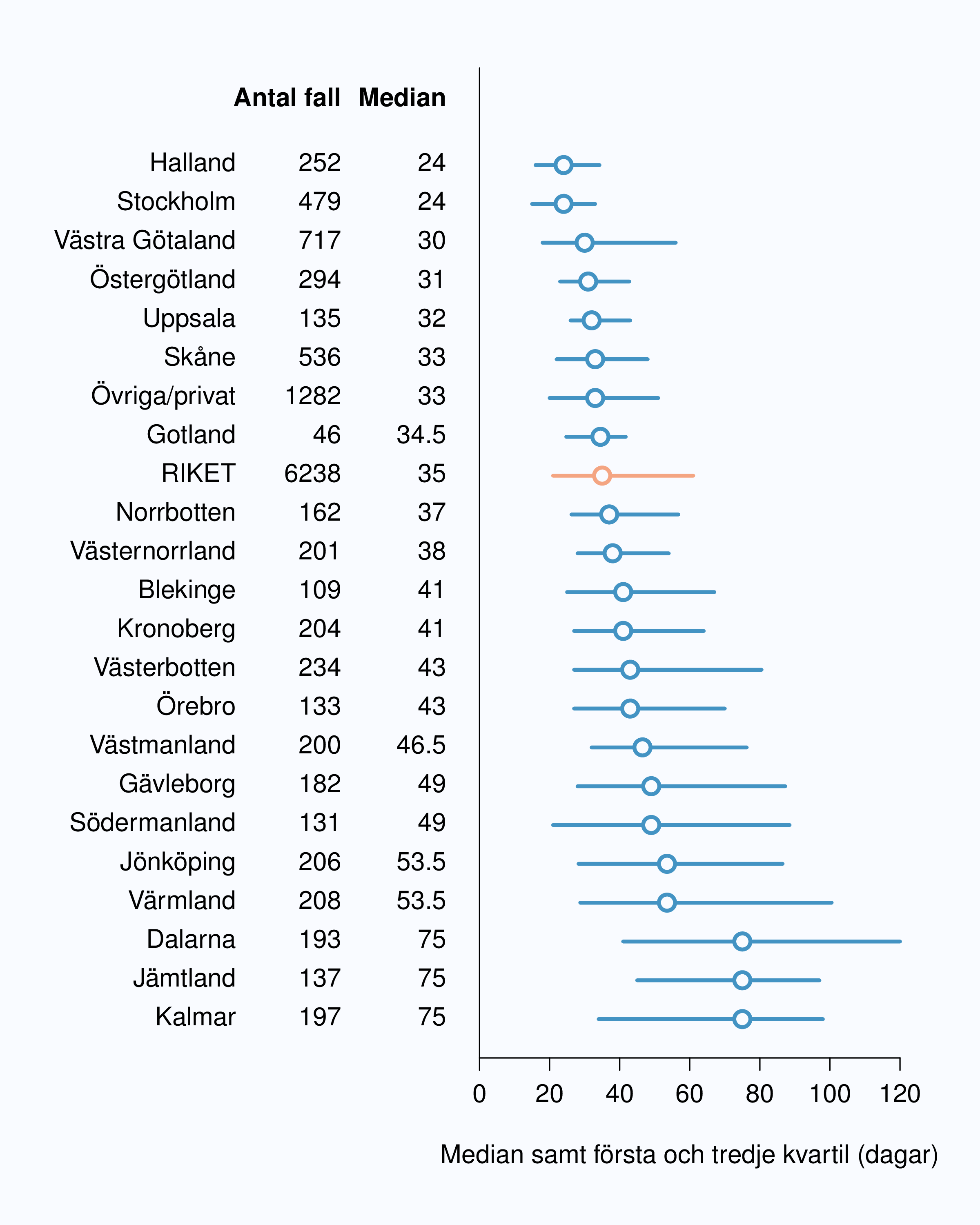
Uppgift saknas för 3.4 % av männen.
Medianväntetiden mellan datum för provtagning (biopsi) till dess att patienten fick PAD-besked var 28 dagar i riket och det fanns en spridning från 19 till 42 dagar mellan landstingen (Figur 9) detta är helt oförändrat jämfört med diagnosår 2011. I tio landsting var medianväntetiden för besked mer än fyra veckor. I NPCR har vi satt målnivån att patienten ska ha PAD-information inom två veckor efter biopsitagning, dvs. patienten ska senast andra kalenderveckan efter biopsitagning ha fått svar på PAD, vilket innebär maximalt 18 dagars väntetid. Den väntetiden är den psykologiskt mest pressande för patienten och därför fokuserar vi på den.
Uppgift saknas för 3.9 % av männen.
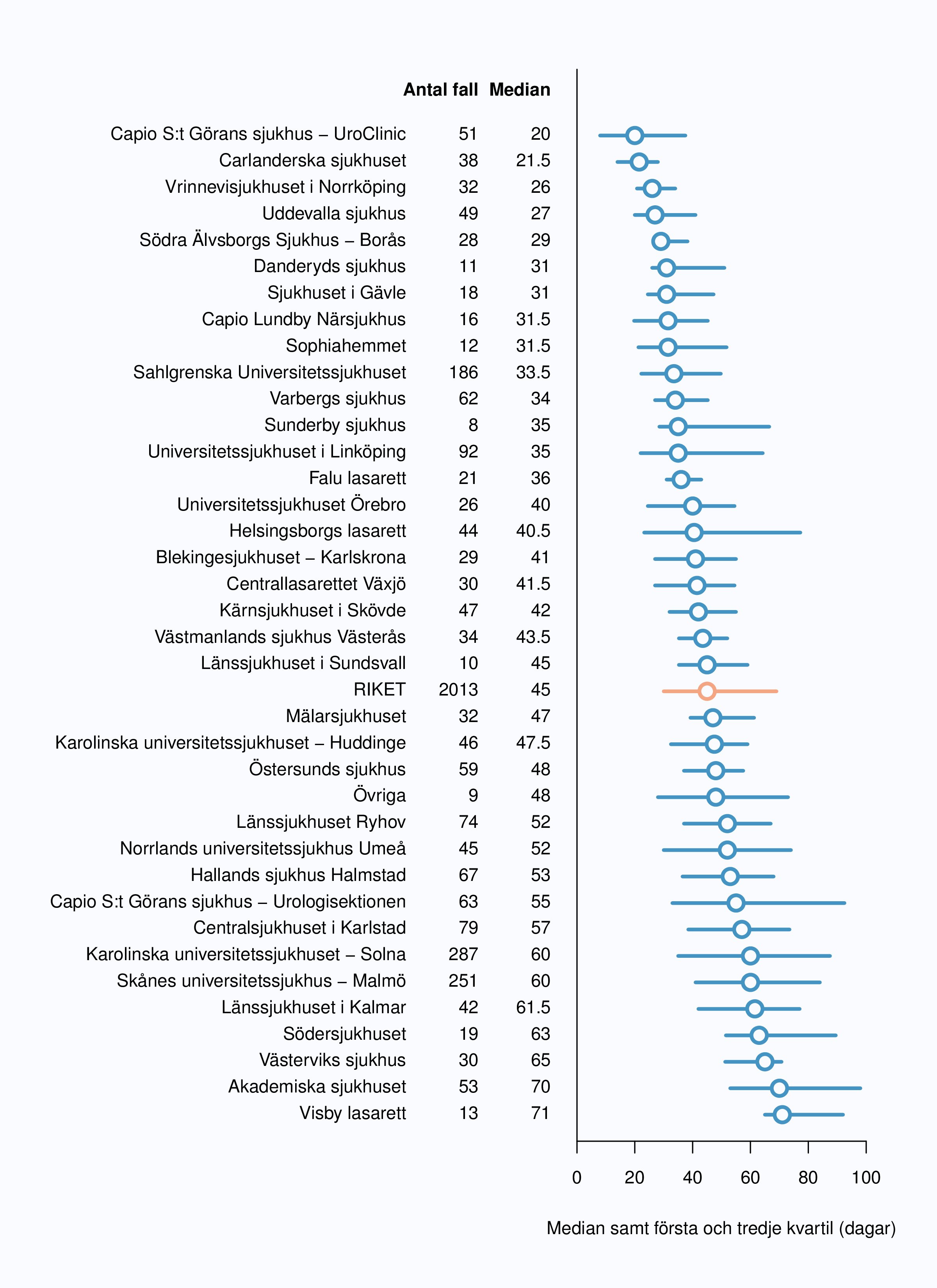
Medianväntetiden för samtliga patienter som behandlades med radikal prostatektomi var 45 dagar från
behandlingsbeslut till operation år 2012, vilket är en sänkning med 6 dagar jämfört med 2011.
Spridning mellan landstingen var 31 till 71 dagar (Figur 11). I figur 13 redovisas dessa väntetider för
respektive opererande sjukhus, där mediantiden från beslut till operation varierade från 21.5 till 71
dagar.
Ur tumörbiologisk synvinkel är det mycket sällan bråttom med operation, definitivt inte för låg- och
intermediärrisk cancer, men ur psykologisk synvinkel för patienten ska väntetiderna inte vara så långa.
En väntetid på 51 dagar från behandlingsbeslut till operation är i jämförelse med andra cancerformer
lång. Exempelvis var tiden från vårdplan (i regel datum för diagnos) till operation bland kvinnor med
bröstcancer cirka 20 dagar, dvs. mindre än hälften så lång som väntetiden mellan beslut att operation
skulle ske till att prostatektomi genomförts.
Uppgift saknas för 0.5 % av männen.
Sjukhus som till figuren bidrog med färre än 5 fall (Nyköpings lasarett, Höglandssjukhuset, Värnamo sjukhus, Alingsås lasarett, Sjukhuset i Lidköping) har grupperats till "Övriga".
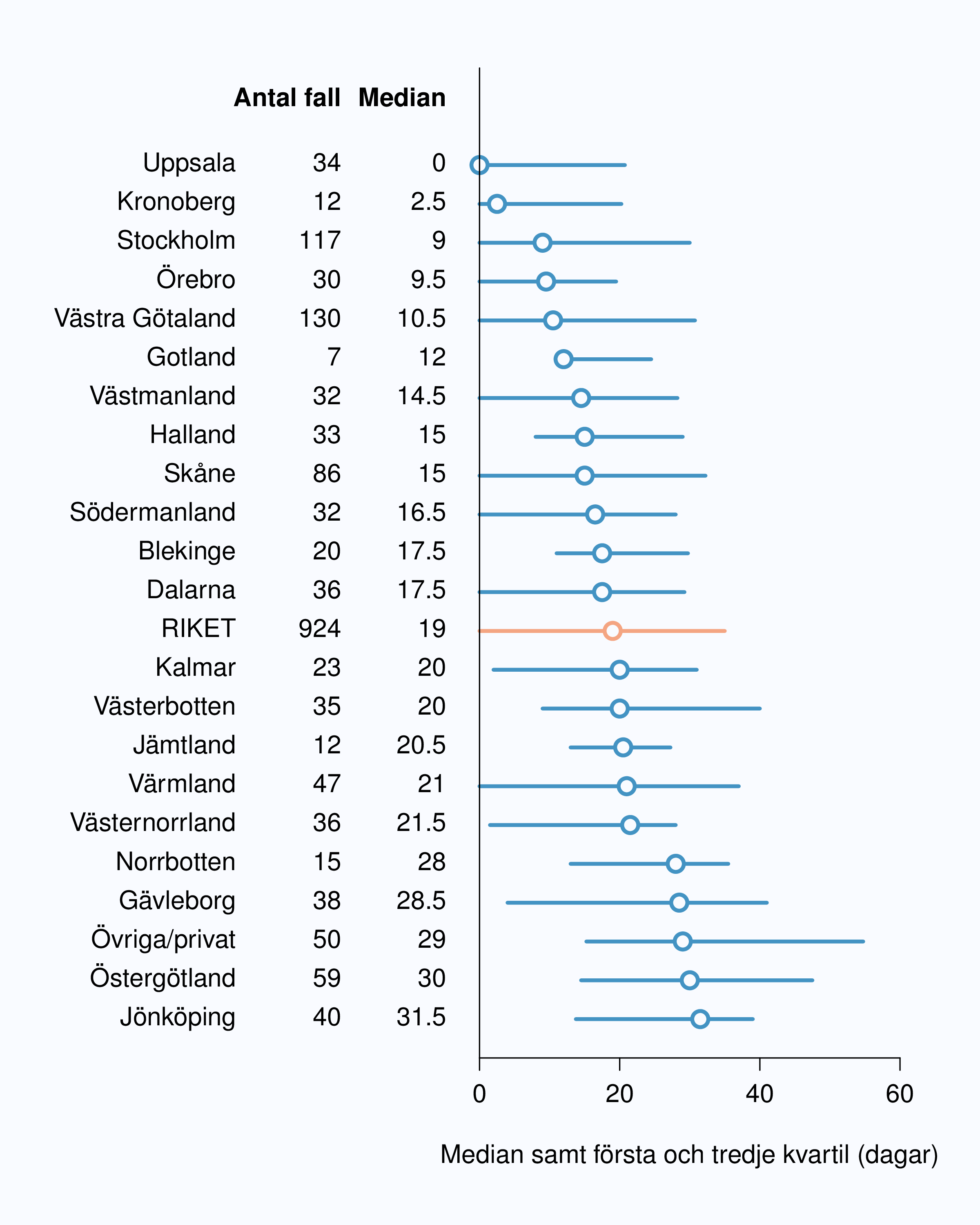
Som mått på kvalitén på omhändertagande av patienter med metastaserad prostatacancer redovisas tid mellan provtagning och behandlingsbeslut, vilket i en stor majoritet av fallen även utgör datum för insatt icke-kurativ behandling. I 98 % av fallen var detta hormonbehandling, vanligen i form av medicinsk kastration och då oftast med GnRH-analog. Mediantiden mellan provtagning och behandling för män med metastaserad prostatacancer var 19 dagar i landet med en spridning från 0 till 31.5 dagar, dvs. oförändrat jämfört med tidigare (Figur 14). Till skillnad från övriga väntetider så var första kvartilsgränsen (när 25 % av patienterna fått ett behandlingsbeslut) noll eller nära noll dagar i 13 landsting, vilket vi tolkar som att patienter med indikation för symtomatisk behandling fick den snabbt.
Uppgift saknas för 0.0 % av männen.
Fördelningen av icke-kurativ terapi finns i tabell 25a-25b på sida §-§.
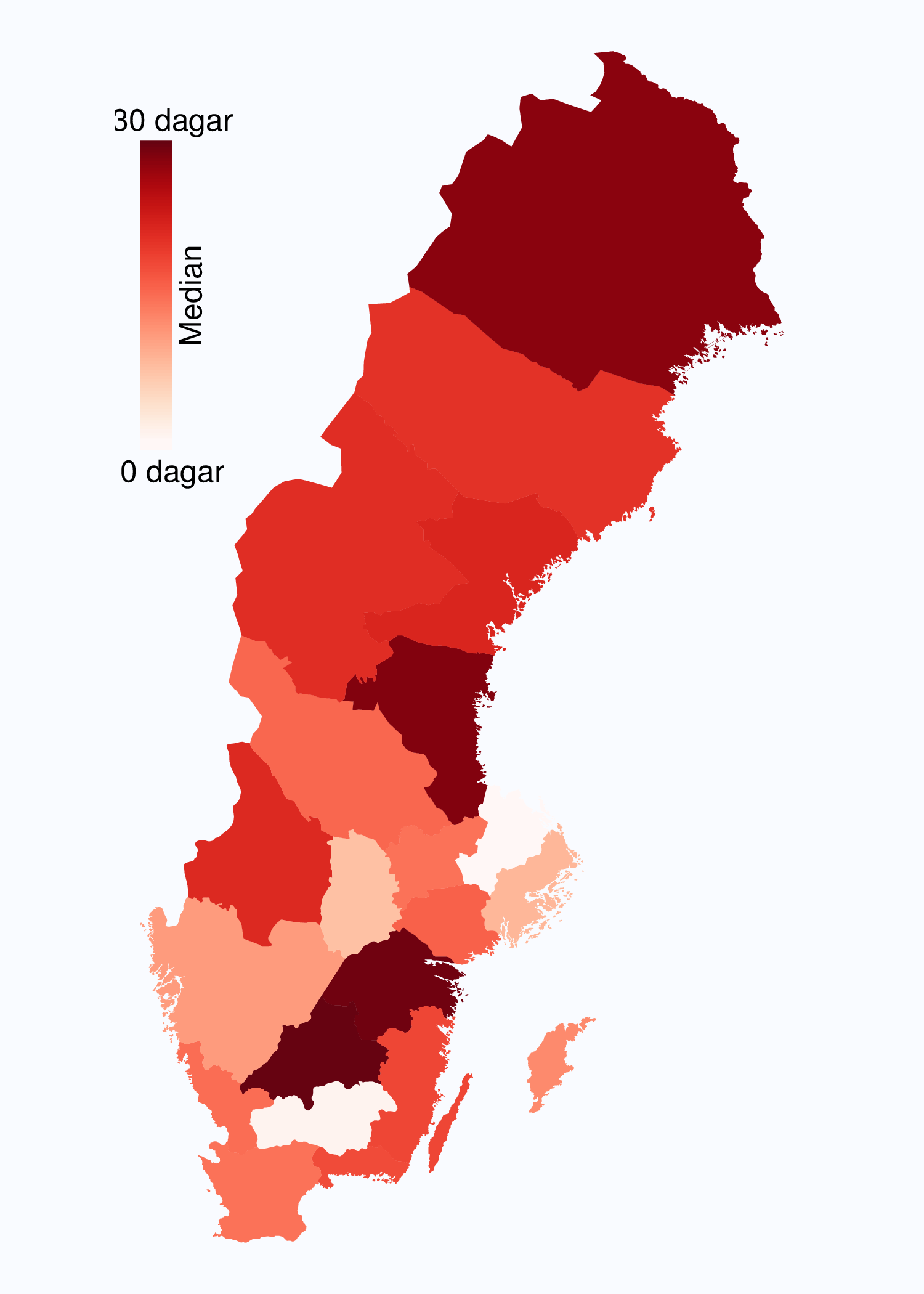
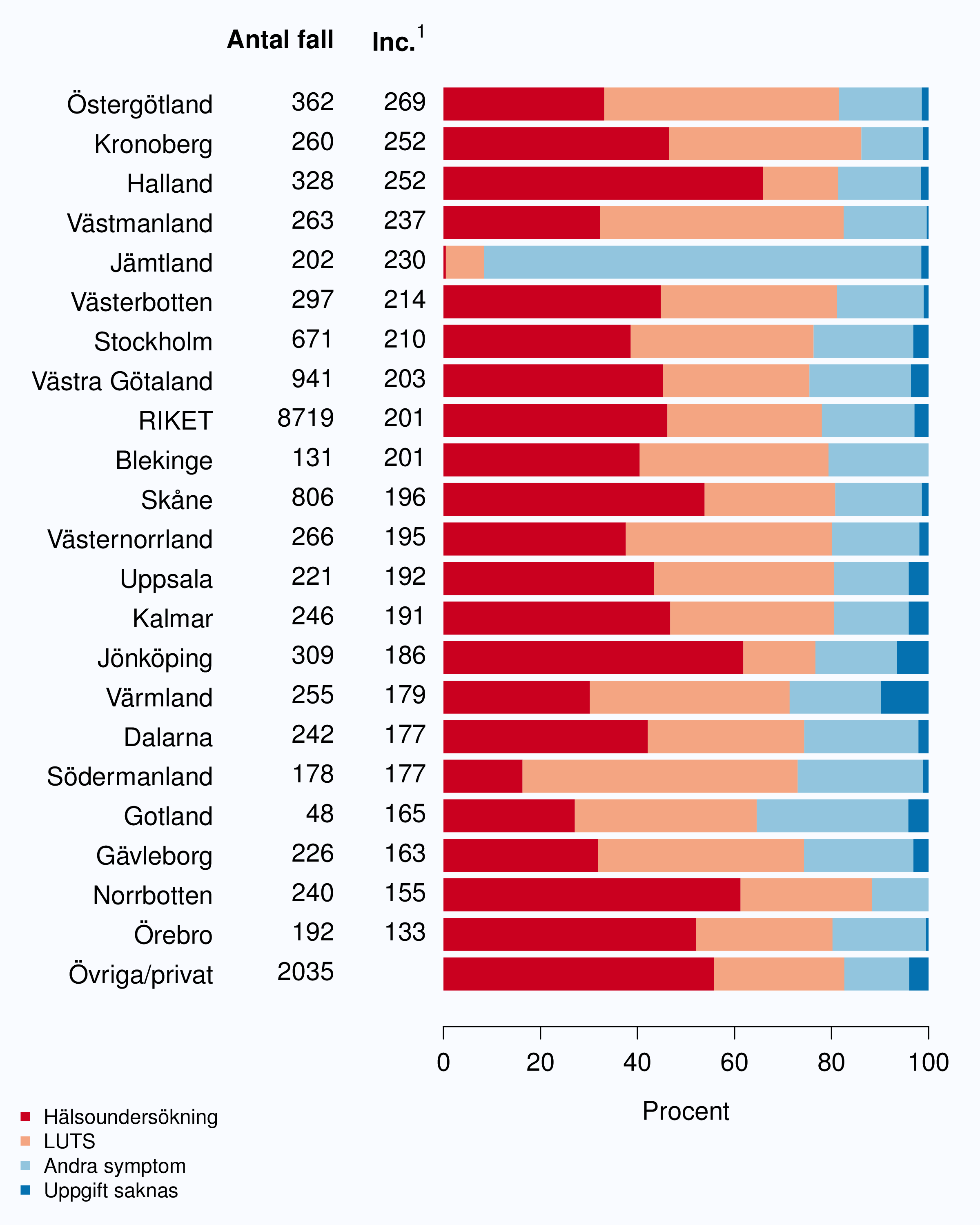
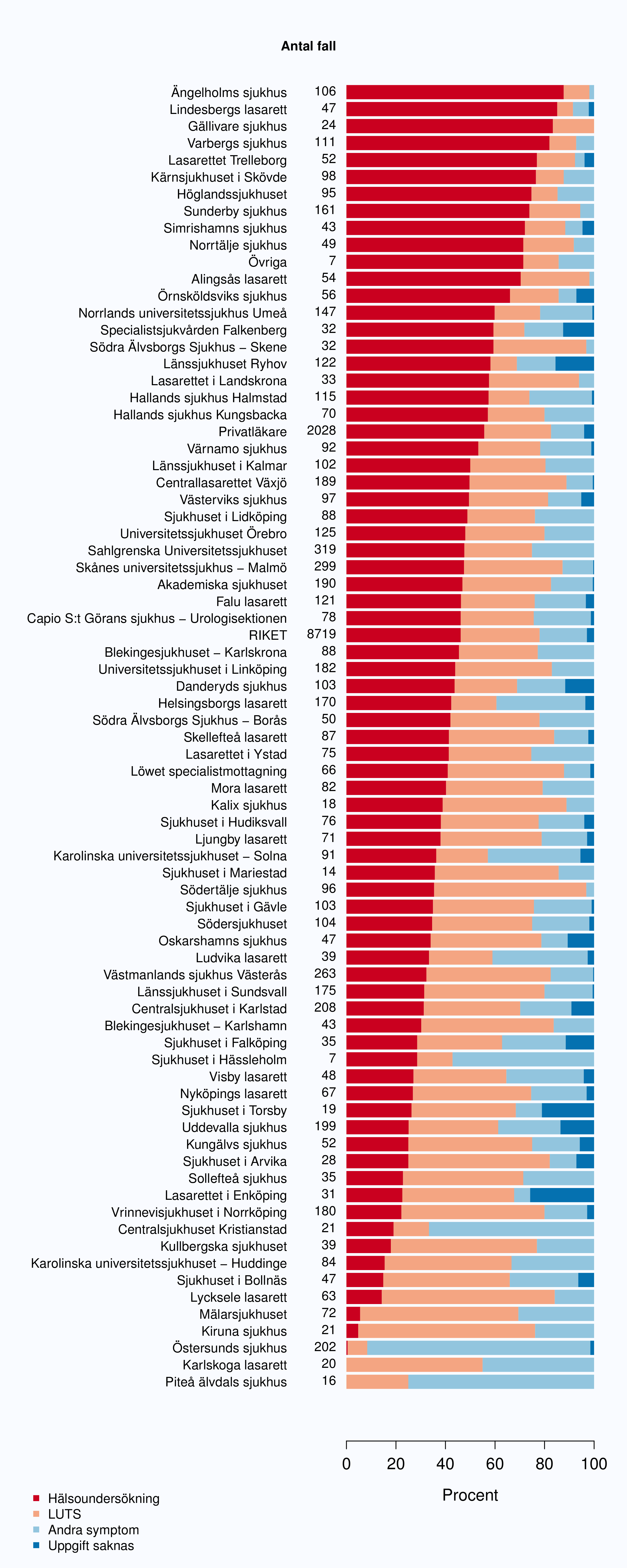
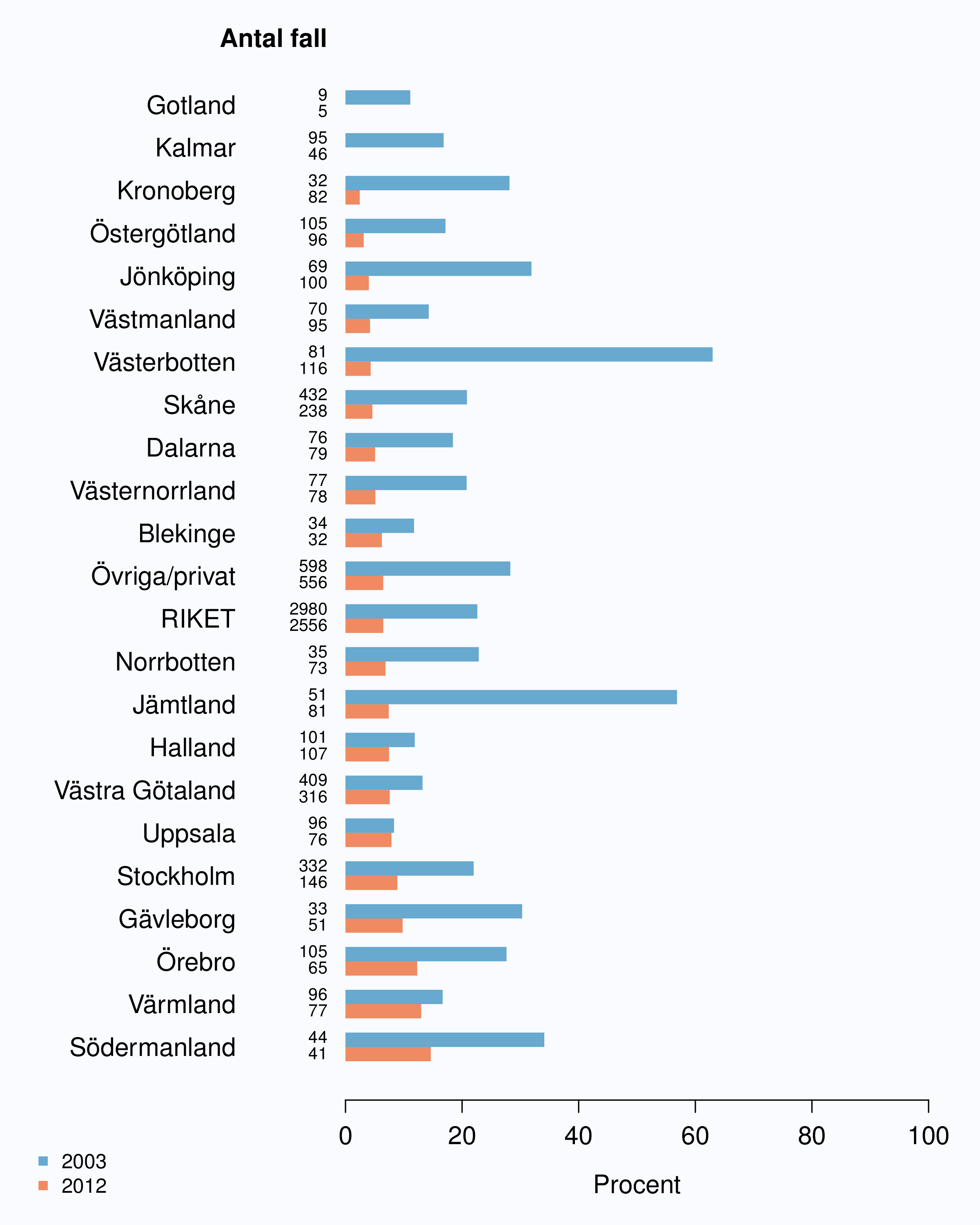
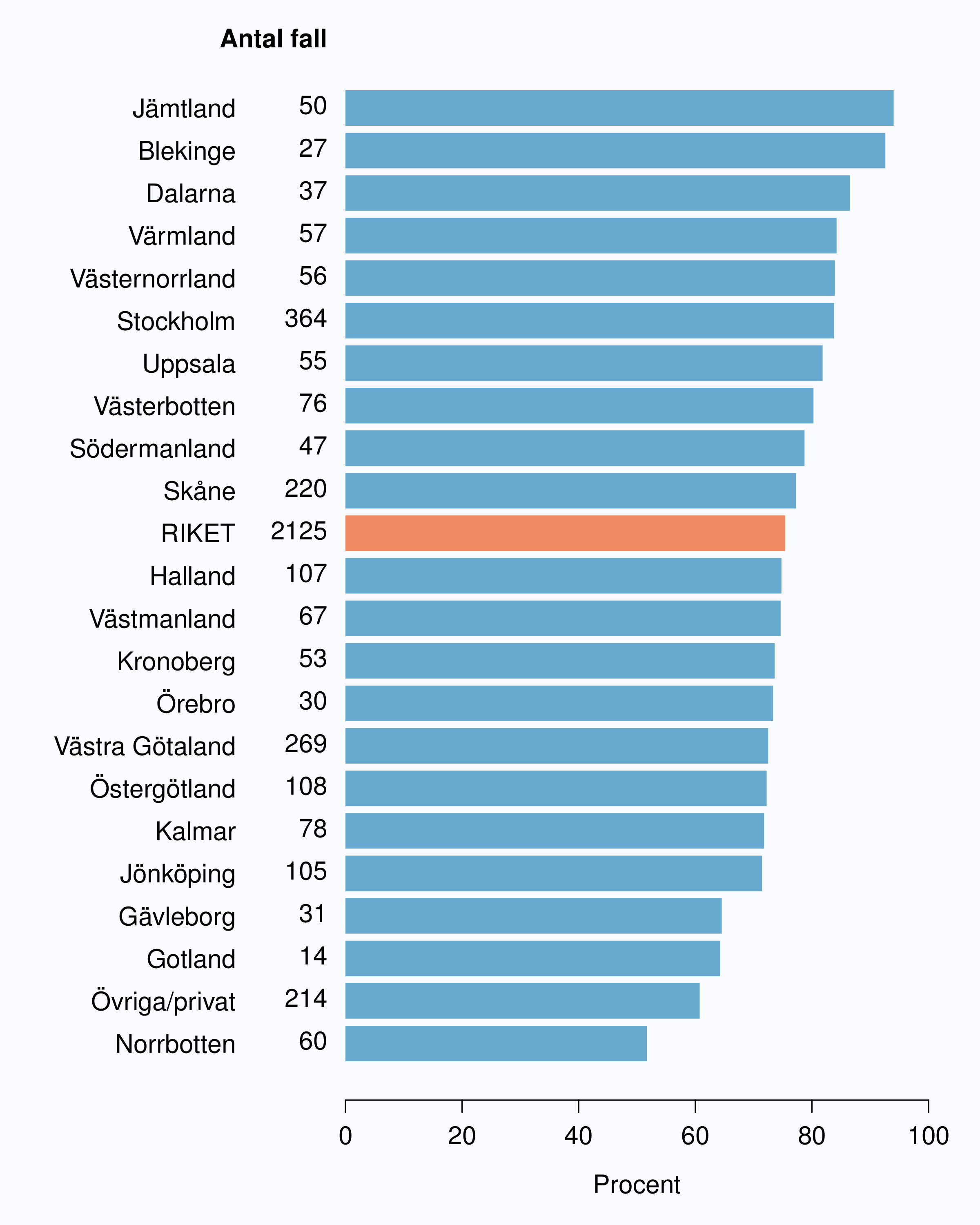
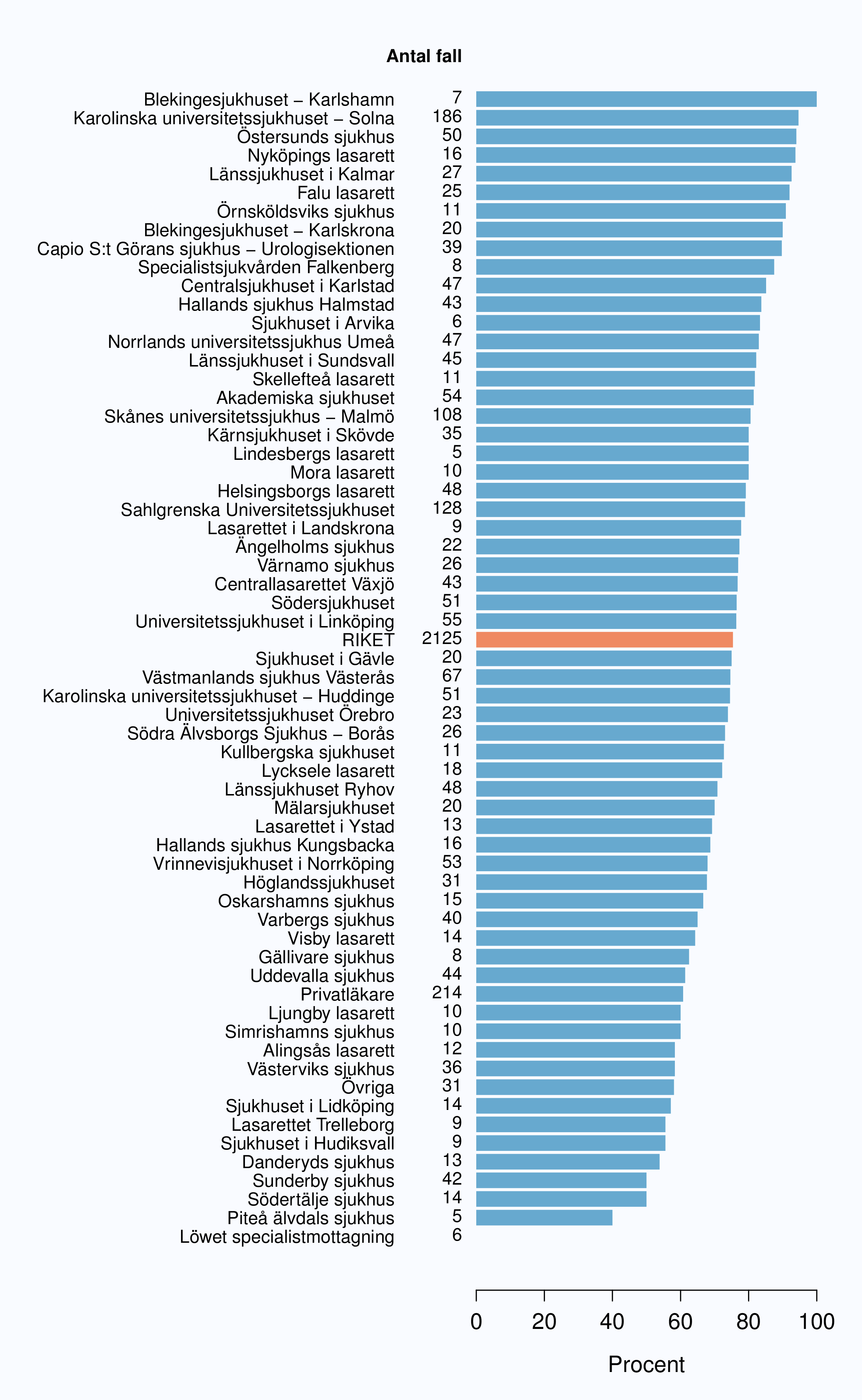
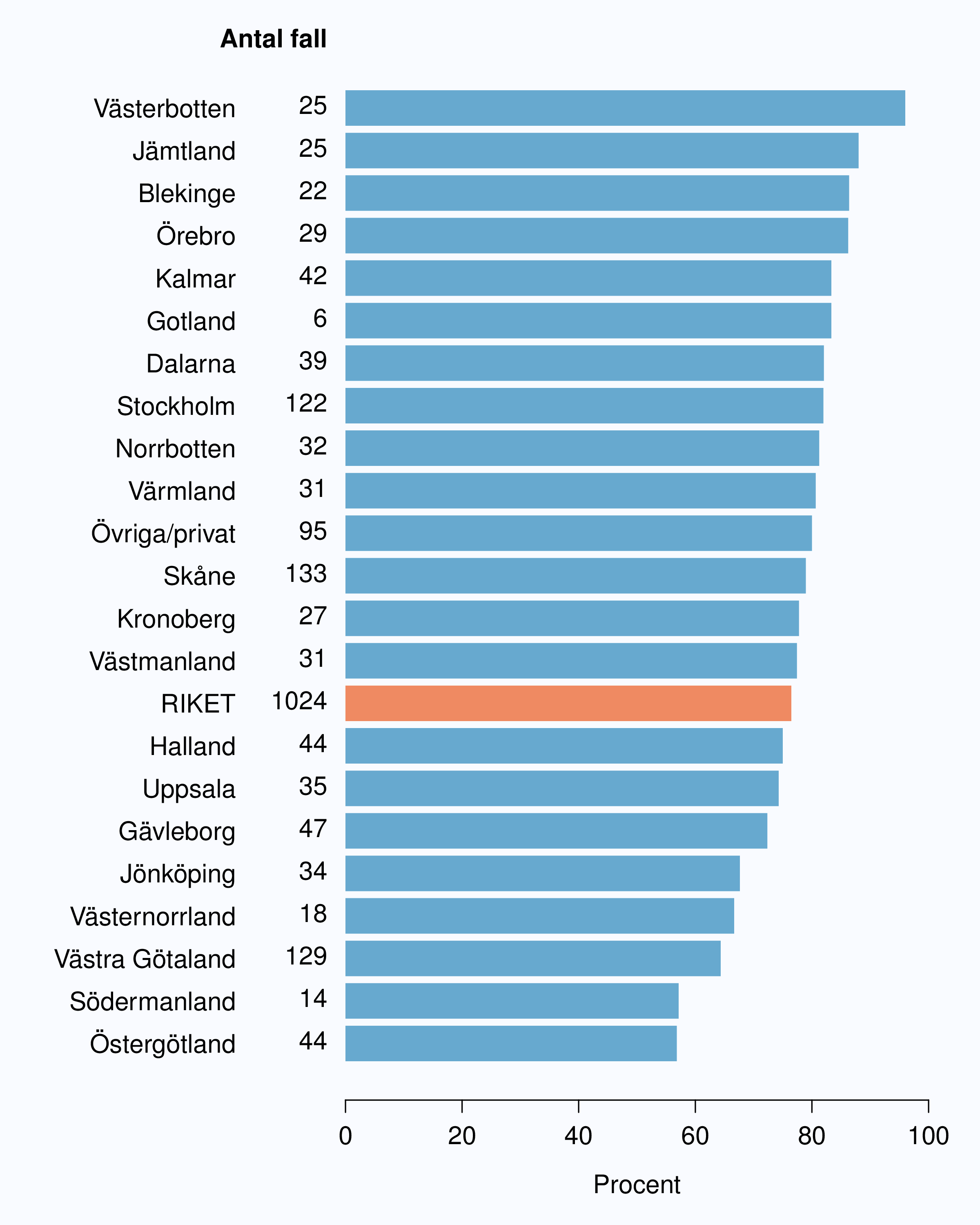
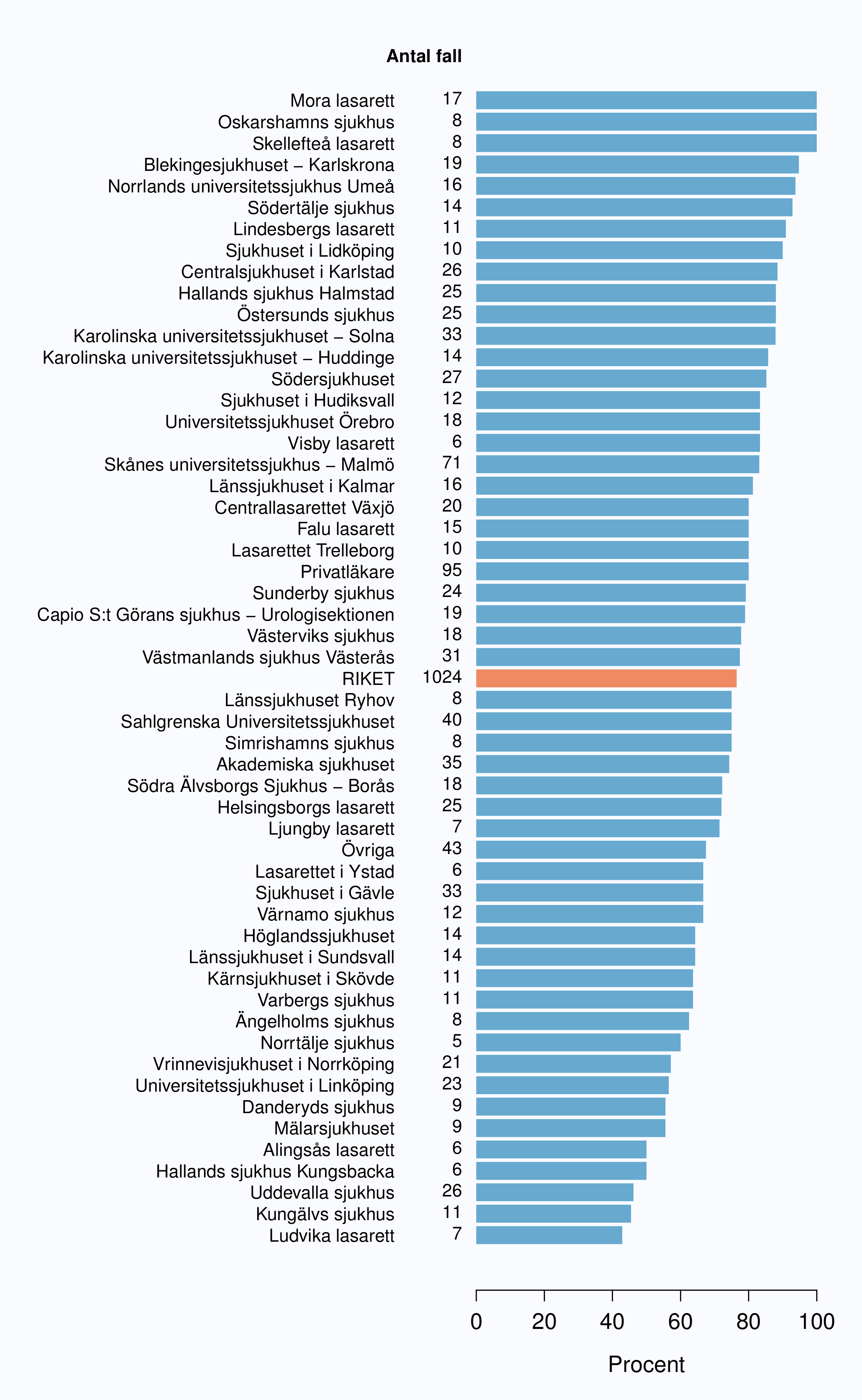
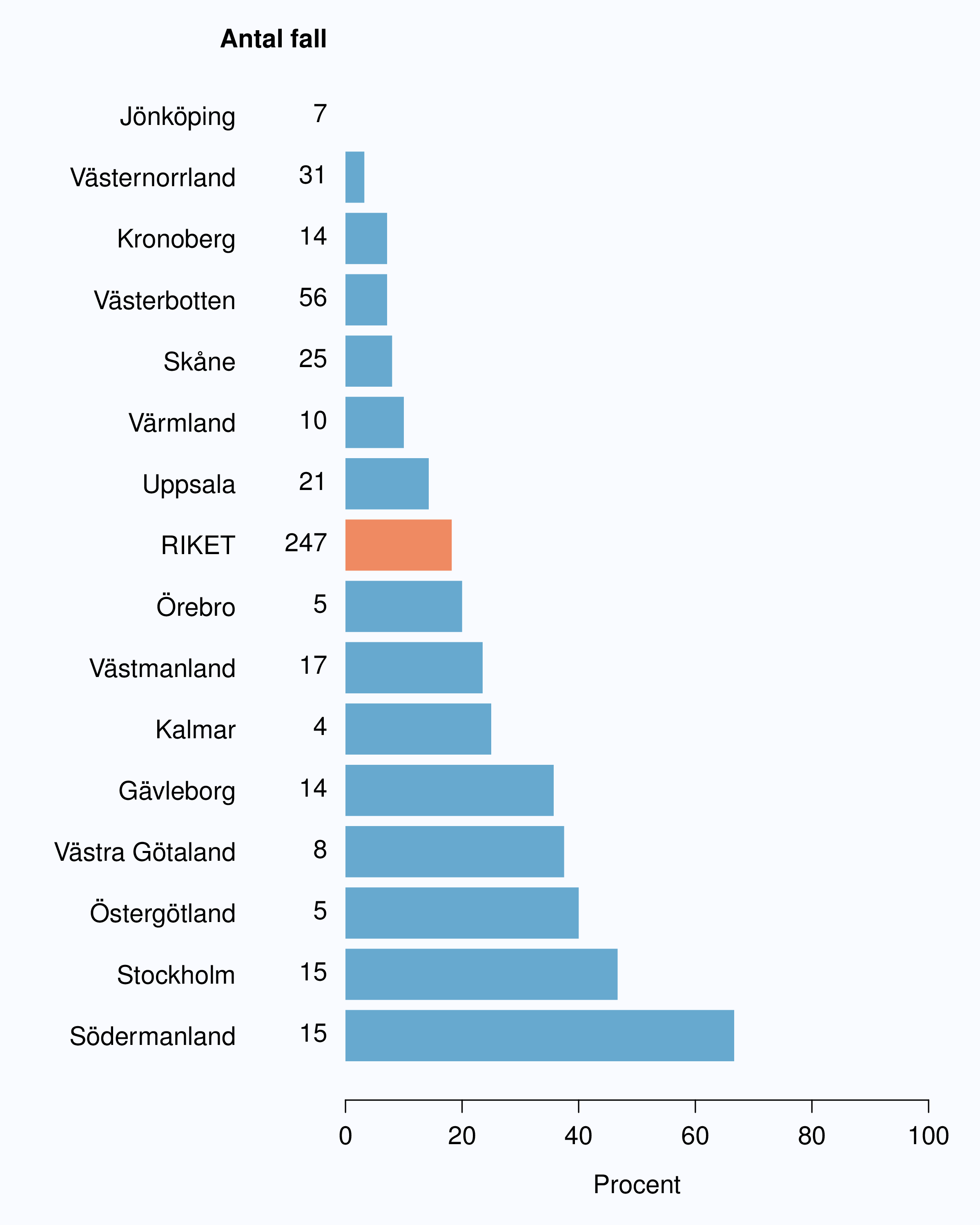
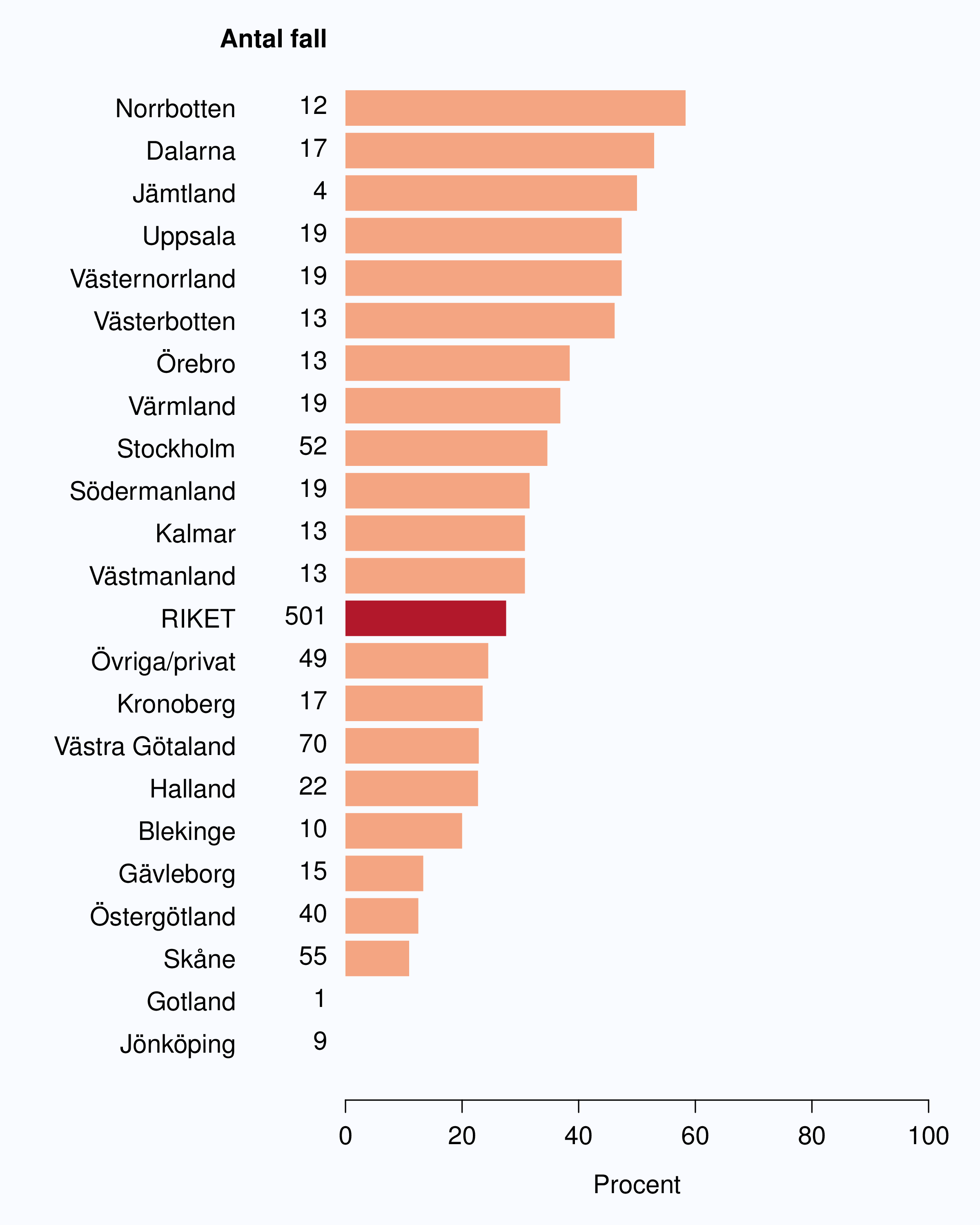
I registret anges en av tre orsaker som anledning till att prostatacancern upptäcktes; hälsoundersökning (PSA-test utan symtom från urinvägarna eller andra symtom), symtom från nedre urinvägarna (LUTS – lower urinary tract symptoms) eller andra symtom/annan orsak. Andelen fall som upptäckts vid en hälsoundersökning med PSA-testning har ökat snabbt. År 2004 upptäcktes 29 % av tumörerna via en hälsoundersökning och den andelen hade ökat till 46 % år 2012 (Tabell 4). Det fanns en stor spridning i andelen tumörer som upptäcktes via hälsoundersökning mellan landstingen och framförallt mellan olika sjukhus (Figur 16 och 17). Dessa stora skillnader speglar den stora variationen i attityd till PSA-testning som finns i landet, skillnaderna visar också på att det är svårt att ur journaltext avgöra om PSA togs som del av en hälsokontroll av en man utan symtom eller togs som del av en utredning av vattenkastningsbesvär. Förekomsten av symtomgivande prostatacancer torde variera obetydlig i den manliga befolkningen i Sverige och vi vet att utbredd PSA-testning leder till hög incidens. Figur 16 visar att sambandet mellan andelen män som i NPCR registrerats som diagnostiserade efter hälsoundersökning och totalincidens är svag. Till exempel var incidensen lägre i Jönköpings län (186/100 000 män) än i Jämtlands län (230/100 000 män), medan andelarna som angavs ha diagnostiserats efter hälsokontroll var 62 % i Jönköpings län respektive <1 % i Jämtland!
| |
Hälsounder- |
LUTS |
Andra symptom |
Uppgift saknas |
Totalt |
| Diagnosår | |||||
| 2004 | 2797 (29) | 3462 (35) | 3096 (32) | 402 (4) | 9757 |
| 2005 | 2740 (28) | 4111 (42) | 2374 (24) | 506 (5) | 9731 |
| 2006 | 2606 (28) | 3957 (43) | 2114 (23) | 488 (5) | 9165 |
| 2007 | 2908 (33) | 3683 (41) | 1906 (21) | 406 (5) | 8903 |
| 2008 | 3075 (35) | 3652 (41) | 1790 (20) | 333 (4) | 8850 |
| 2009 | 4457 (42) | 3821 (36) | 1910 (18) | 324 (3) | 10512 |
| 2010 | 4117 (42) | 3470 (36) | 1913 (20) | 251 (3) | 9751 |
| 2011 | 4173 (44) | 3293 (34) | 1864 (20) | 227 (2) | 9557 |
| 2012 | 4024 (46) | 2779 (32) | 1663 (19) | 253 (3) | 8719 |
Vid PSA-testning av symtomfria män anger Socialstyrelsens Riktlinjer för prostatacancersjukvård [4,5] att en skriftlig och muntlig information om möjliga konsekvenser av provet ska ges innan provtagningen (prioritet 2). Socialstyrelsen har för det ändamålet tagit fram en informationsfolder i samarbete med bland annat Svensk Urologisk Förening. Vi har uppdaterat en undersökning om hur information använts bland män diagnostiserade under 2009-2011 med en svarsfrekvens på 1653/1800 = 92 %. Männens prostatacancer hade diagnostiserats vid en hälsoundersökning och i en brevenkät tillfrågades de om de hade informerats om konsekvenserna av PSA-testet innan blodprovet togs [6]. Sexton procent hade fått skriftlig information och 47 % av männen angav att de fått enbart muntlig information. Dessa resultat tyder på att skriftlig information om PSA-testets konsekvenser fortfarande används i liten utsträckning och att broschyren tyvärr förefaller ha haft ett lågt genomslag. Tidigare undersökning för män med diagnos under 2006-2008 visade på likartat resultat.
1 Åldersstandardiserad incidens av prostatacancer i motsvarande län år 2011.
Medianvärdet för PSA-nivån vid diagnos, ett robust mått på i vilket skede cancern upptäcks, har sjunkit kraftigt under en 10-årsperiod, från 23 μg/L år 1998 till 9 μg/L år 2012 (Tabell 5). Andelen tumörer som upptäckts i intervallet 4-10 μg/L har dubblerats samtidigt som gruppen av män med PSA 20-100 μg/L och högre än 100 μg/L har halverats (Figur 18). Dessa stora förändringar bekräftar att en ökande andel fall diagnostiseras p.g.a. PSA-testning av symtomfria män. Täckningen för denna viktiga prognostiska variabel är god, för 98 % av fallen i NPCR finns ett PSA-värde mätt i blodprov i anslutning till diagnosdatum tillgängligt sedan 1998.
| |
Median |
Första kvartil |
Tredje kvartil |
Uppgift saknas (%) |
Totalt |
| Diagnosår | |||||
| 1998 | 23 | 9.9 | 70 | 230 (4) | 6136 |
| 1999 | 20 | 9.1 | 58 | 265 (4) | 7155 |
| 2000 | 18 | 8.8 | 53 | 230 (3) | 7234 |
| 2001 | 16 | 7.9 | 47 | 217 (3) | 7448 |
| 2002 | 15 | 7.5 | 44 | 167 (2) | 7621 |
| 2003 | 13.5 | 7.2 | 37 | 191 (2) | 8855 |
| 2004 | 11.9 | 6.7 | 29 | 191 (2) | 9757 |
| 2005 | 11 | 6.1 | 28 | 177 (2) | 9731 |
| 2006 | 10.9 | 6 | 28 | 256 (3) | 9165 |
| 2007 | 10 | 6 | 27 | 192 (2) | 8903 |
| 2008 | 10 | 5.9 | 26 | 180 (2) | 8850 |
| 2009 | 9.5 | 5.7 | 22 | 236 (2) | 10512 |
| 2010 | 9.1 | 5.6 | 21 | 233 (2) | 9751 |
| 2011 | 8.8 | 5.4 | 20 | 236 (2) | 9557 |
| 2012 | 8.6 | 5.3 | 21 | 220 (3) | 8719 |
| Totalt | 11.9 | 6.3 | 32 | 3221 (2) | 129394 |
Ett annat område där utvecklingen har varit snabb är tekniken vid prostatabiopsier med hjälp av
transrektal ultraljudsundersökning. Allt fler vävnadskolvar tas vid samma provtagningsomgång, och
bedövning används sedan några år i en allt större utsträckning vid provtagningen. Ju fler biopsier som
tas desto större är sannolikheten att en prostatacancer diagnostiseras. Riktlinjerna för
prostatacancersjukvård anger att 8 till 12 kolvar ska tas, och om aktiv monitorering är aktuell
ska två omgångar av biopsier tas för att utesluta en behandlingskrävande prostatacancer.
Antalet tagna biopsikolvar vid en biopsisession har ökat mellan 2007 och 2012 (Tabell 6), vilket
är i linje med internationella trender. Det fanns en viss spridning i hur många biopsier
som togs i landet, mindre än sex biopsier togs i liten utsträckning och i enstaka landsting
tog man tretton eller fler biopsier. Andel män som genomgick åtta eller fler biopsier i den
diagnostiserande biopsiomgången redovisas per län i figur 19 och per sjukhus i figur 20, på de
allra flesta mottagningar tas idag åtta eller fler biopsier i enighet med gällande riktlinjer.
I en enkät via Svenskt Urologiskt Nätverk (SUNe) undersöktes biopsitekniken bland 137 svenska
urologer [7]. I korthet visade undersökningen att lokalbedövning innan provtagningen användes av
87 % av dessa urologer, och att 84 % regelbundet tog 10 kolvar eller mer i en biopsiseans, medan
bara 66 % regelbundet biopserade främre prostata, ett område där cancer ofta är svår att
påvisa.
| |
<6 |
6-9 |
10-12 |
13+ |
Uppgift saknas |
Totalt |
| Diagnosår | ||||||
| 2007 | 545 (8) | 4176 (58) | 1647 (23) | 76 (1) | 783 (11) | 7227 |
| 2008 | 589 (7) | 4103 (46) | 3173 (36) | 109 (1) | 876 (10) | 8850 |
| 2009 | 586 (6) | 3762 (36) | 5051 (48) | 212 (2) | 901 (9) | 10512 |
| 2010 | 474 (5) | 2926 (30) | 5150 (53) | 332 (3) | 869 (9) | 9751 |
| 2011 | 471 (5) | 2332 (24) | 5571 (58) | 346 (4) | 837 (9) | 9557 |
| 2012 | 467 (5) | 1794 (21) | 5387 (62) | 354 (4) | 717 (8) | 8719 |
Regionen Stockholm-Gotland exkluderad för 2007.
Den internationella klassifikationen av skelettmetastaser har ändrats så att alla fall där skelettmetastaser inte påvisats klassificeras som M0. Det betyder att kategorin Mx, dvs. där undersökning av skelett inte har skett, har utgått. I 2012 års formulär har vi infört en uppgift om skelettundersökning har genomförts, och i så fall vilken typ av undersökning.
Uppgift saknas för 9.9 % (2012) respektive 2.1 % (2003) av männen.
Uppgift saknas för 9.2 % (2012) respektive 0.9 % (2003) av männen.
Uppgift saknas för 9.4 % (2012) respektive 0.9 % (2003) av männen.
Efter genomförd behandling eller senast sex månader efter diagnos skall patientens primärbehandling rapporteras. Täckningsgraden för denna registrering är mycket god i NPCR. För 2012 var 8211 primärbehandlingsblanketter inrapporterade i oktober 2013, vilket innebär 94 % täckning (Tabell 7).
| |
Stockholm- |
Uppsala- |
Sydöstra |
Södra |
Västra |
Norra |
Totalt |
| Diagnosår | |||||||
| 2007 | 1383 (83) | 1816 (99) | 1094 (100) | 1514 (93) | 1797 (100) | 867 (100) | 8471 (95) |
| 2008 | 1494 (93) | 1821 (100) | 1049 (100) | 1714 (99) | 1701 (100) | 924 (99) | 8703 (98) |
| 2009 | 1961 (97) | 2245 (100) | 1395 (100) | 1867 (100) | 1945 (100) | 1023 (100) | 10436 (99) |
| 2010 | 1852 (98) | 1923 (100) | 1212 (98) | 1666 (99) | 1949 (100) | 1072 (99) | 9674 (99) |
| 2011 | 1702 (95) | 1930 (99) | 1170 (97) | 1775 (99) | 1847 (100) | 957 (98) | 9381 (98) |
| 2012 | 1443 (83) | 1667 (97) | 1036 (93) | 1560 (98) | 1526 (99) | 979 (97) | 8211 (94) |
Stockholm-Gotland registrerade ej via INCA under 2007.
I NPCR skall anges vilken behandlingsstrategi som har valts; konservativ behandling (aktiv
monitorering och symtomstyrd terapi särskiljs sedan 2007), kurativ terapi eller icke-kurativ terapi.
Icke-kurativ terapi innebär i den absoluta majoriteten av fall (98 %) hormonbehandling.
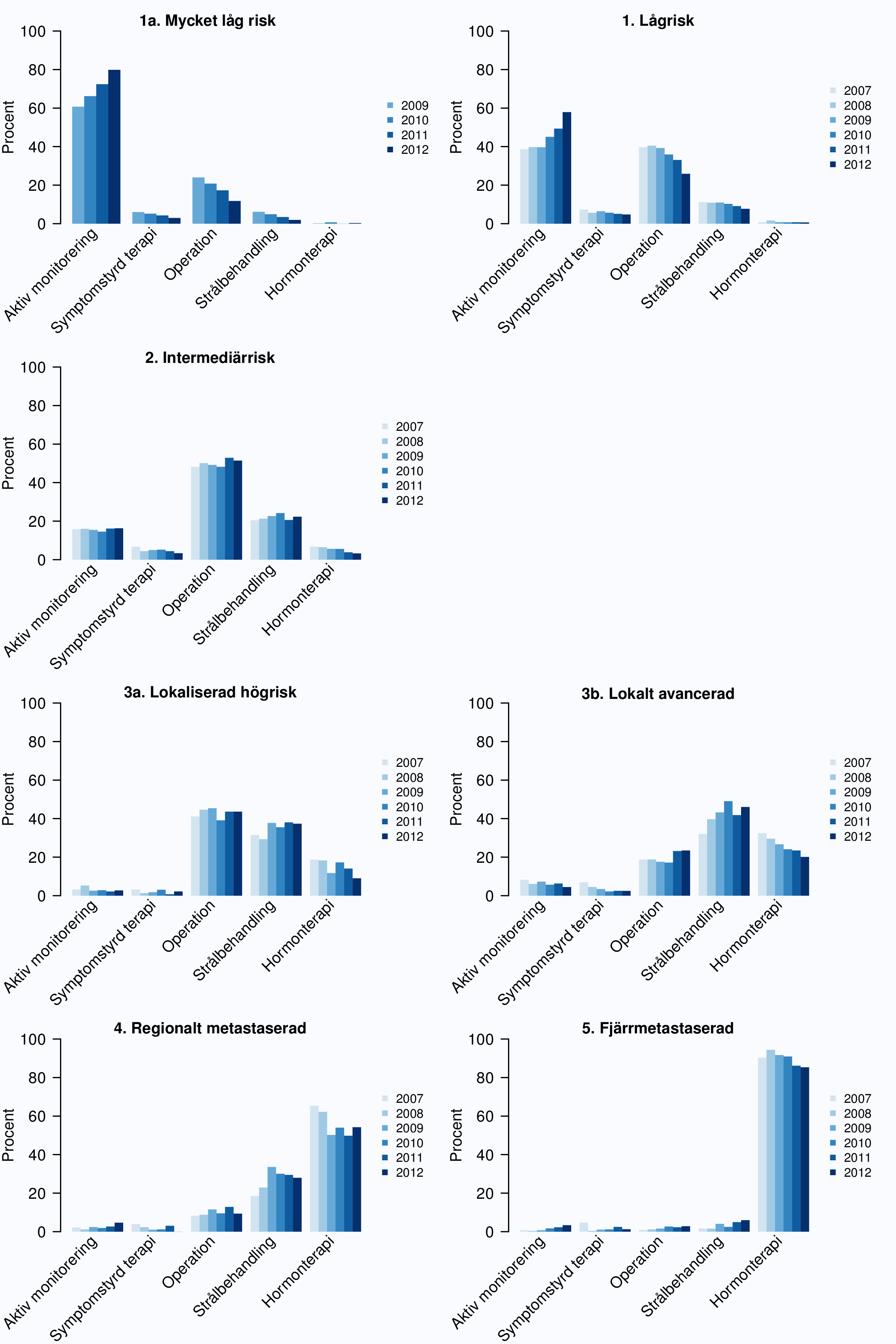
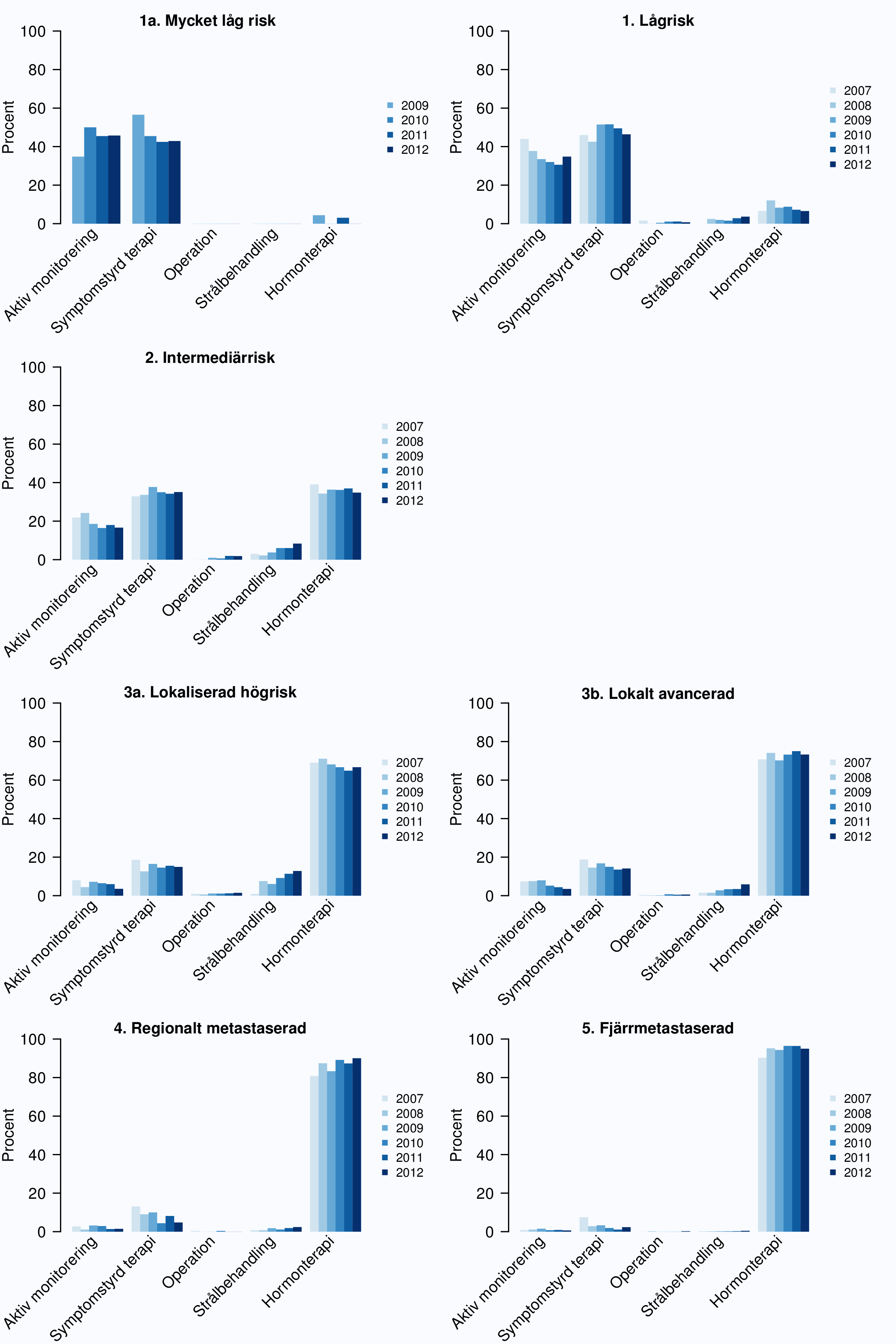
Figur 24-27 visar primärbehandling för fem riskkategorier och hur behandlingen har förändrats över
tid. Sedan 2007 särskiljs behandlingsstrategierna aktiv monitorering och symtomstyrd terapi (Figur 25
och 26). Aktiv monitorering innebär att ingen behandling ges primärt utan att patienten istället följs
regelbundet med PSA-kontroller och re-biopsier av prostata. Vid tecken till progress behandlas
patienten med operation eller strålning. Symtomstyrd terapi innebär att patienten följs och
hormonbehandling ges vid symtomatisk progress. För män 75 år eller yngre med lågrisk cancer har
andelen som följs med aktiv monitorering ökat medan en något större andel män med
intermediärrisk, högrisk och lokalt avancerad cancer får kurativ behandling (Figur 25). Tydligast är
ökningen av strålbehandling vid lokalt avancerad cancer, vilket visar att SPCG-7 studien [8],
som rapporterade en ökad överlevnad för män som erhållit kombination av strålterapi och
hormonbehandling, har haft inverkan på valet av behandlingsstrategi för denna patientgrupp.
Figur 27 visar att andelen män som genomgår kurativ behandling är starkt åldersberoende i alla
riskkategorier, likaså är bruket av hormonbehandling bland män med lokaliserade högrisktumörer
och regionalt metastaserade tumörer åldersberoende. Sammantaget visar dessa data på
att behandlingen i allt större utsträckning differentieras i gruppen av icke-metastaserade
cancrar, allt fler män med lågrisktumörer ställs på aktiv monitorering och allt fler män med
högrisktumörer opereras eller strålas. Men fortfarande förekommer både överbehandling av
lågrisktumörer och underbehandling av högrisktumörer, det senare mest uttalat bland något äldre
män.
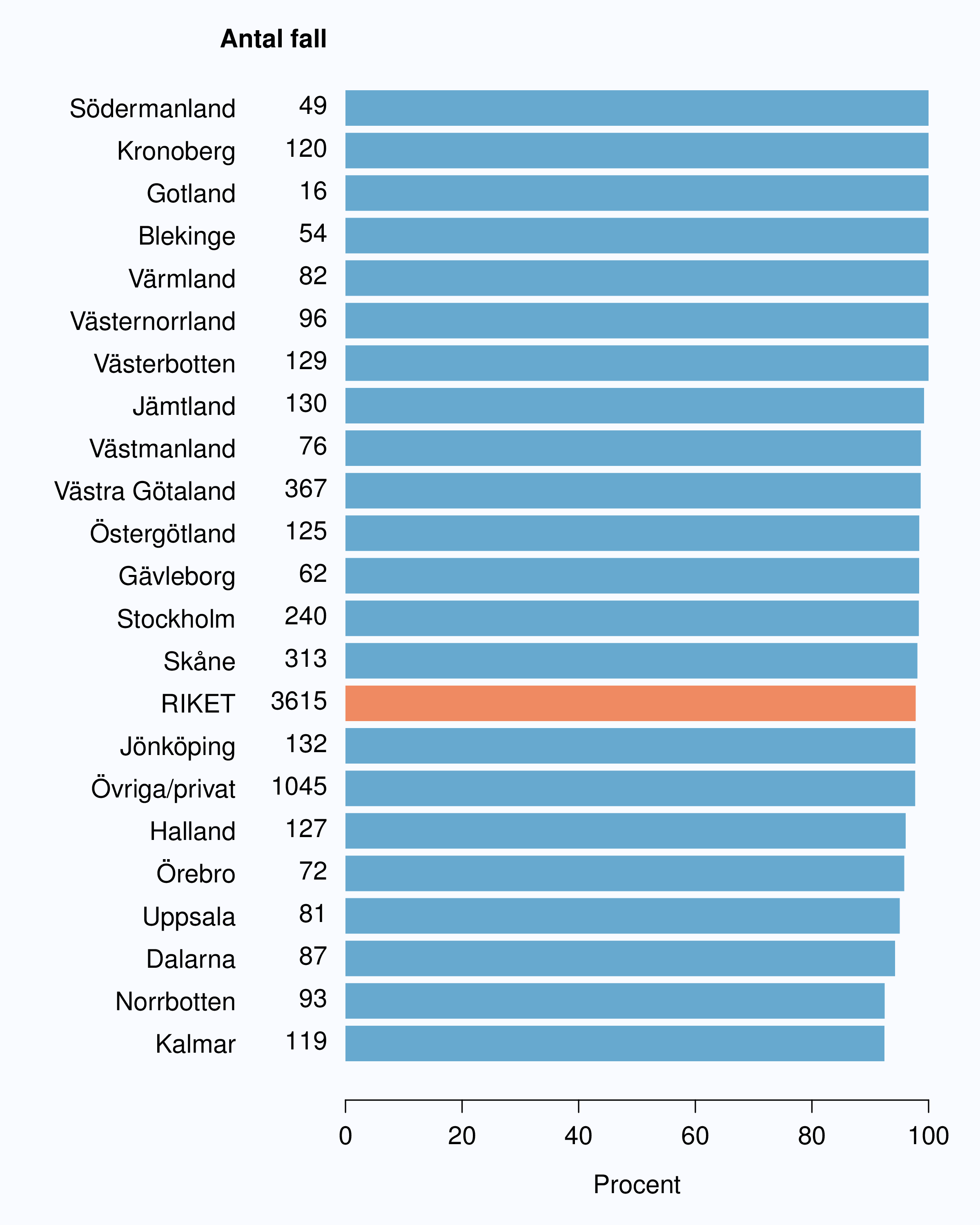
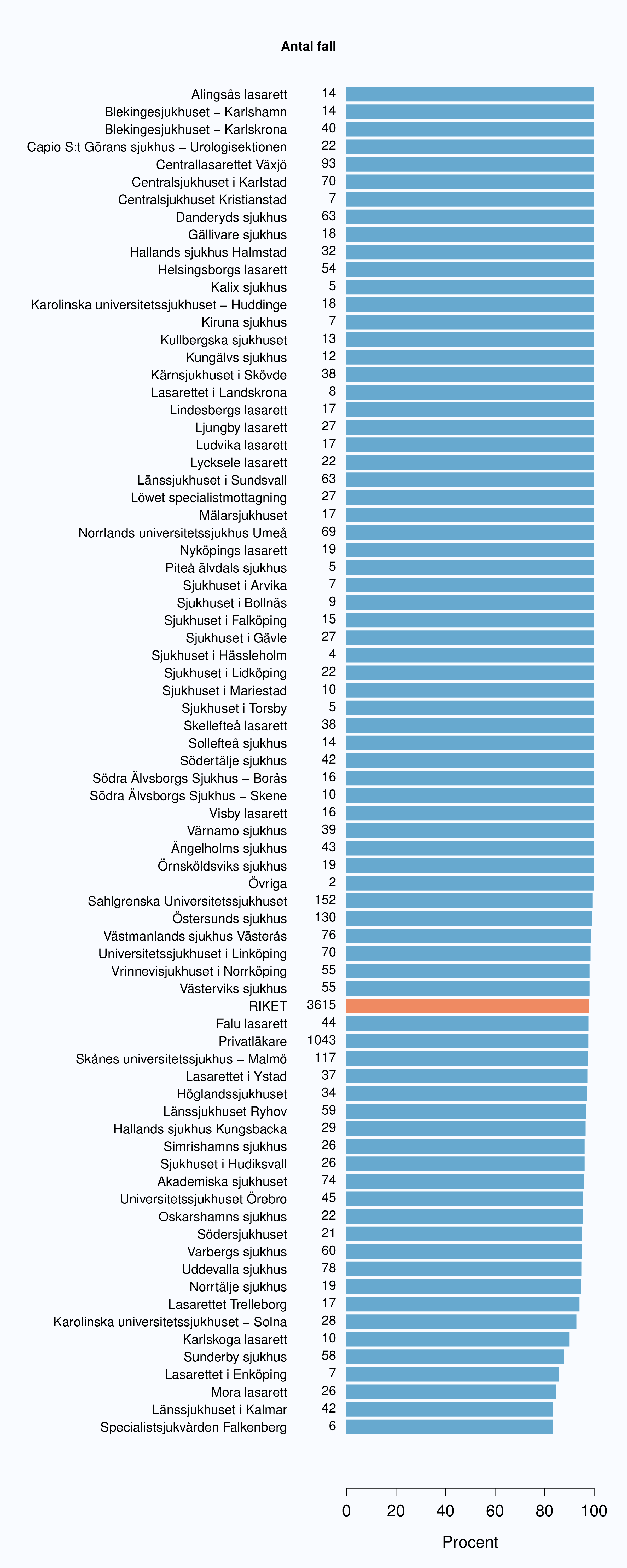
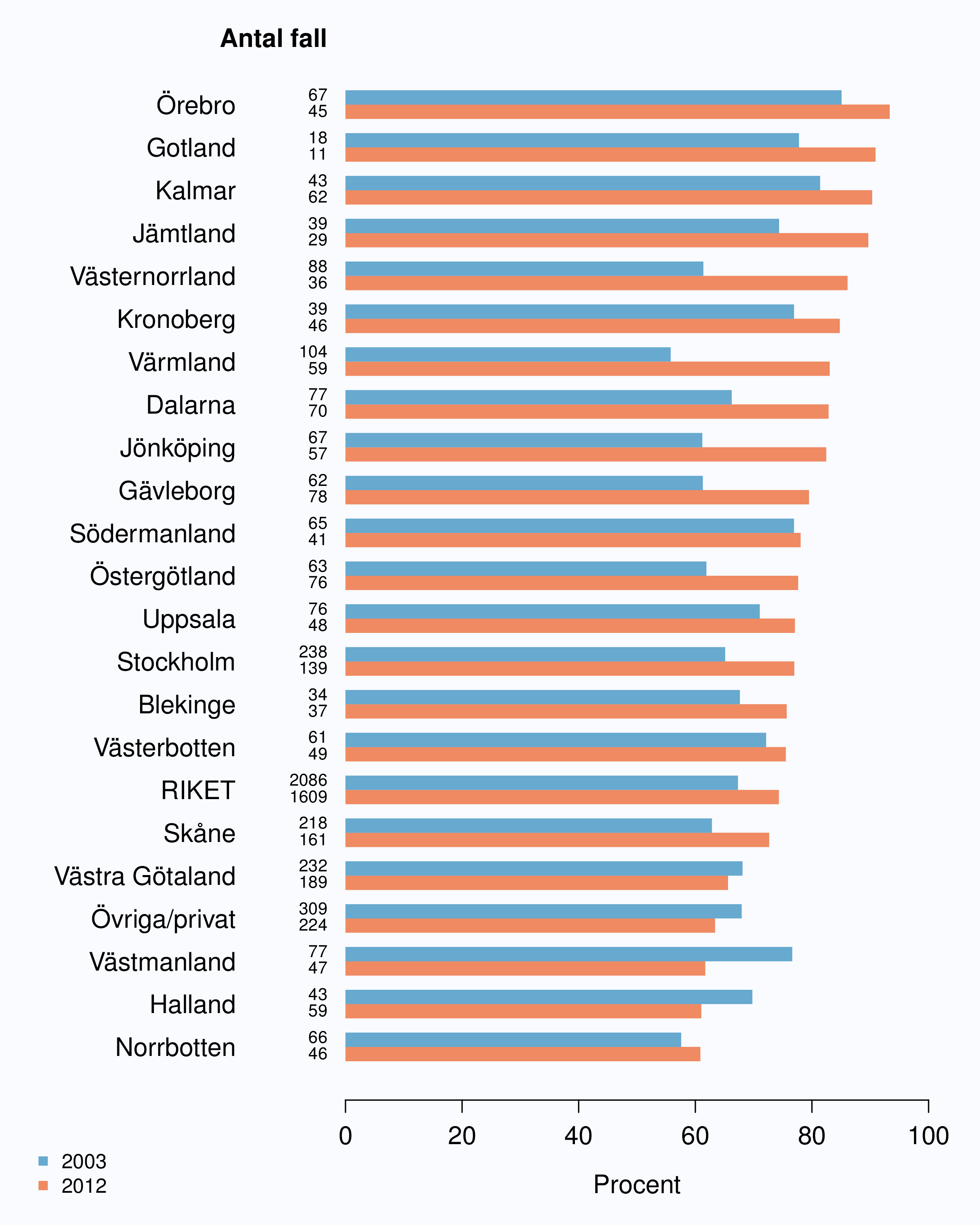
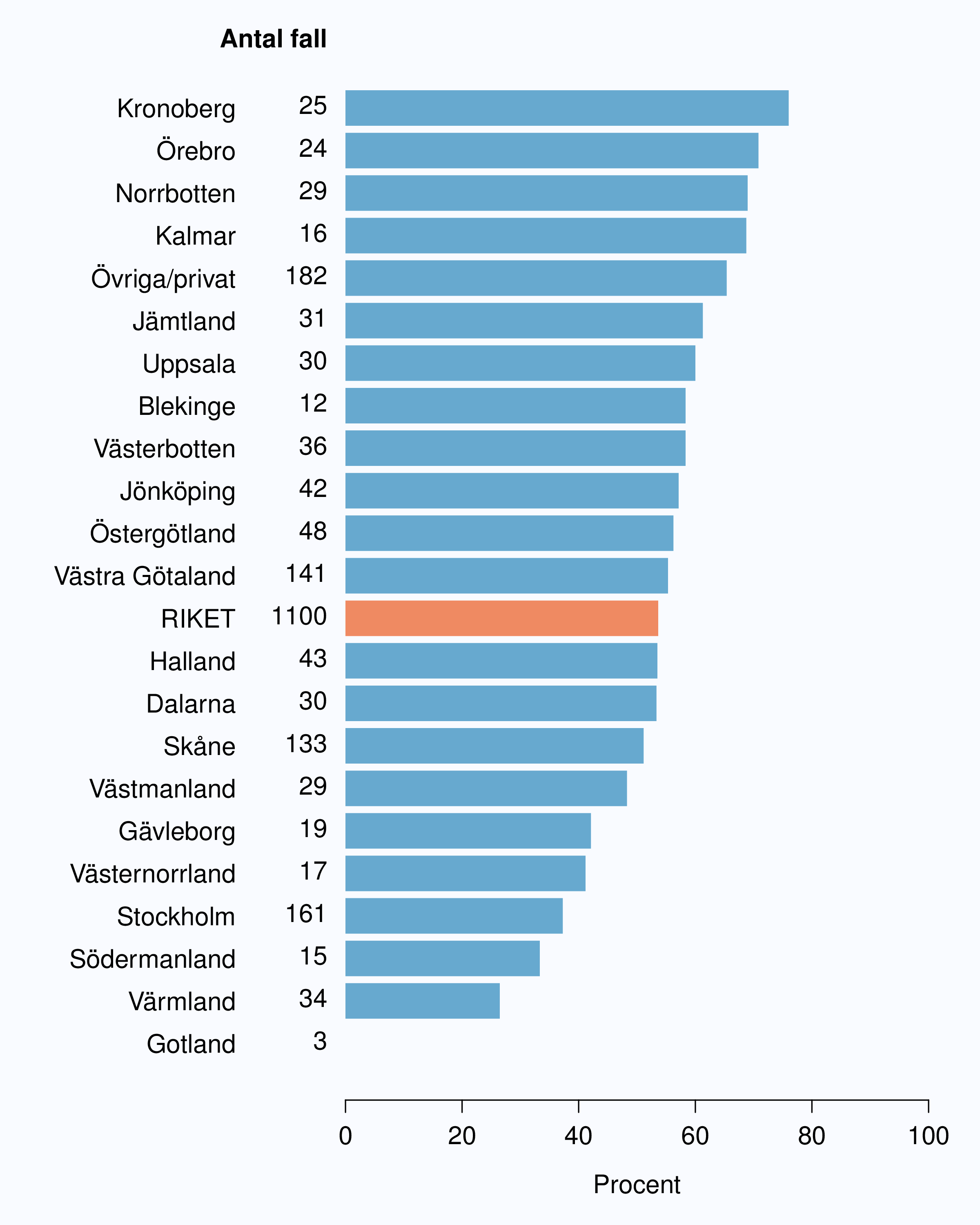
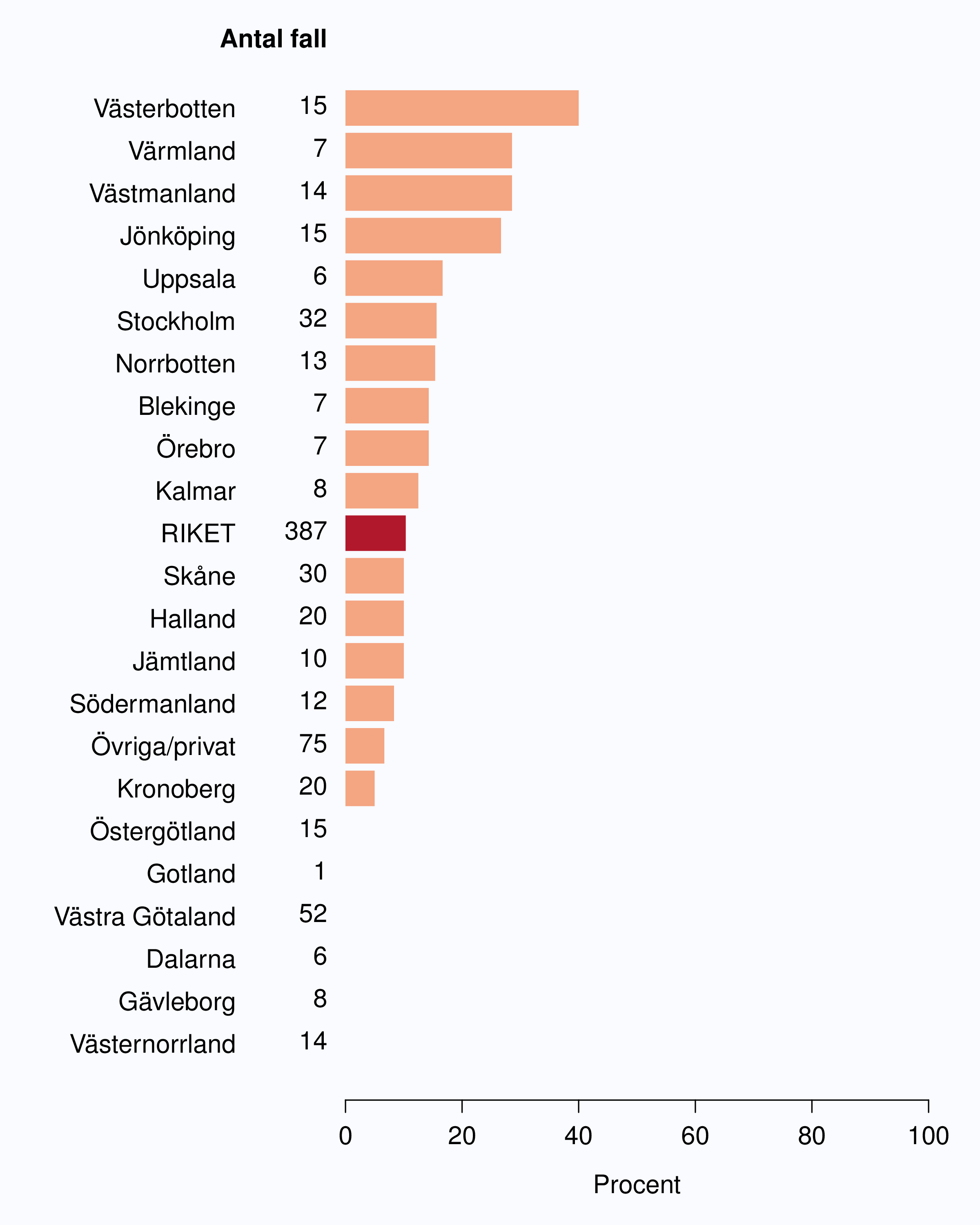
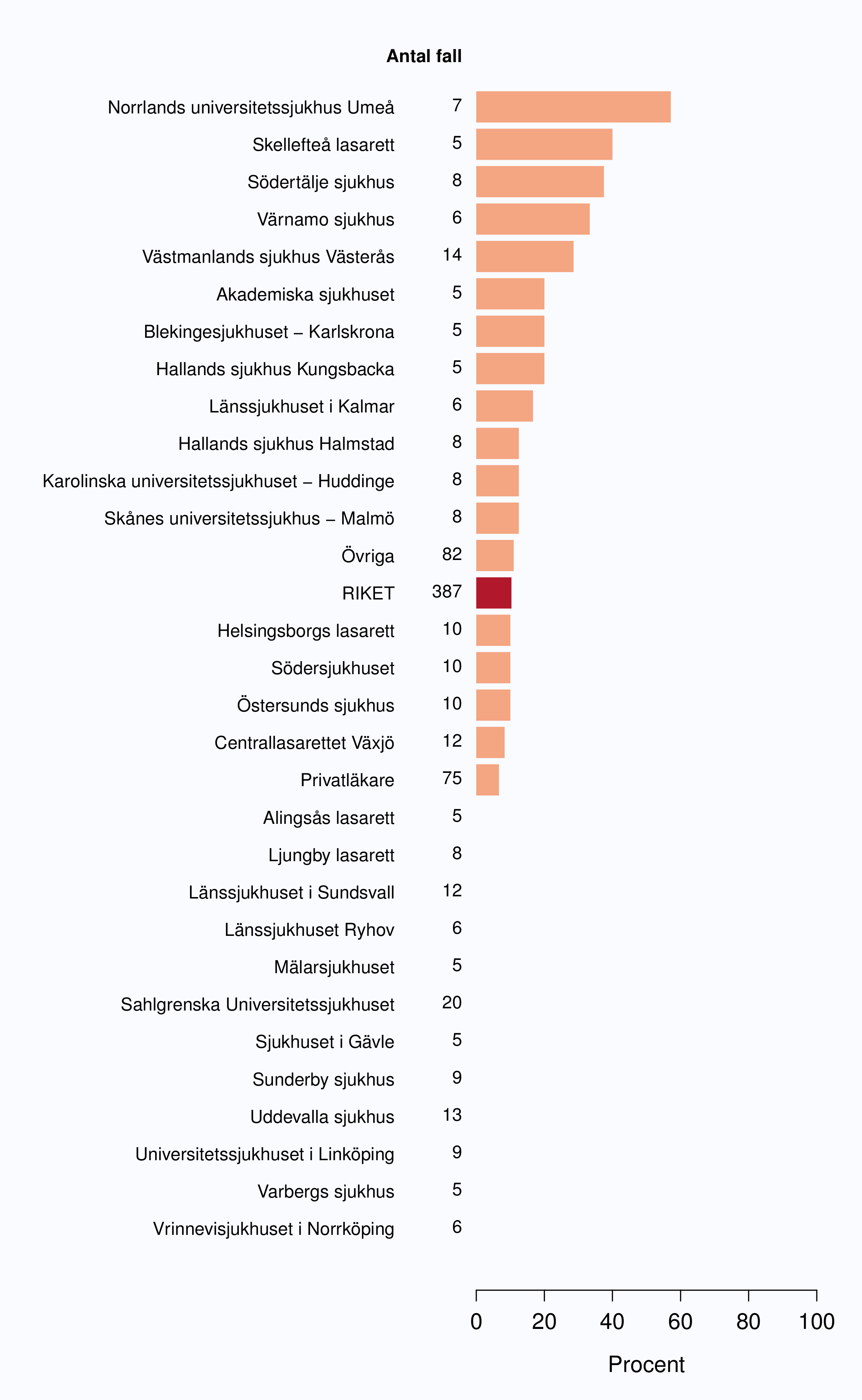
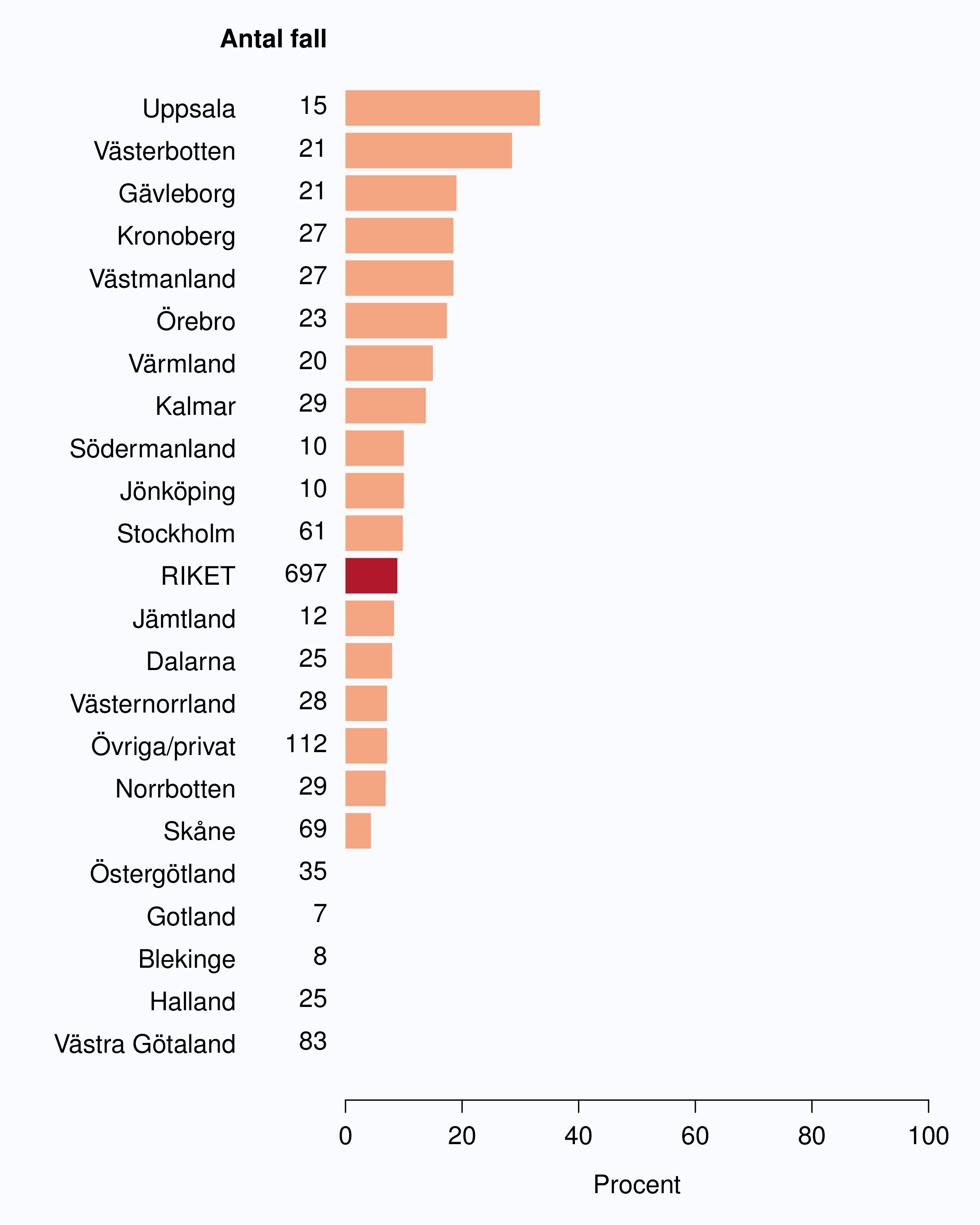
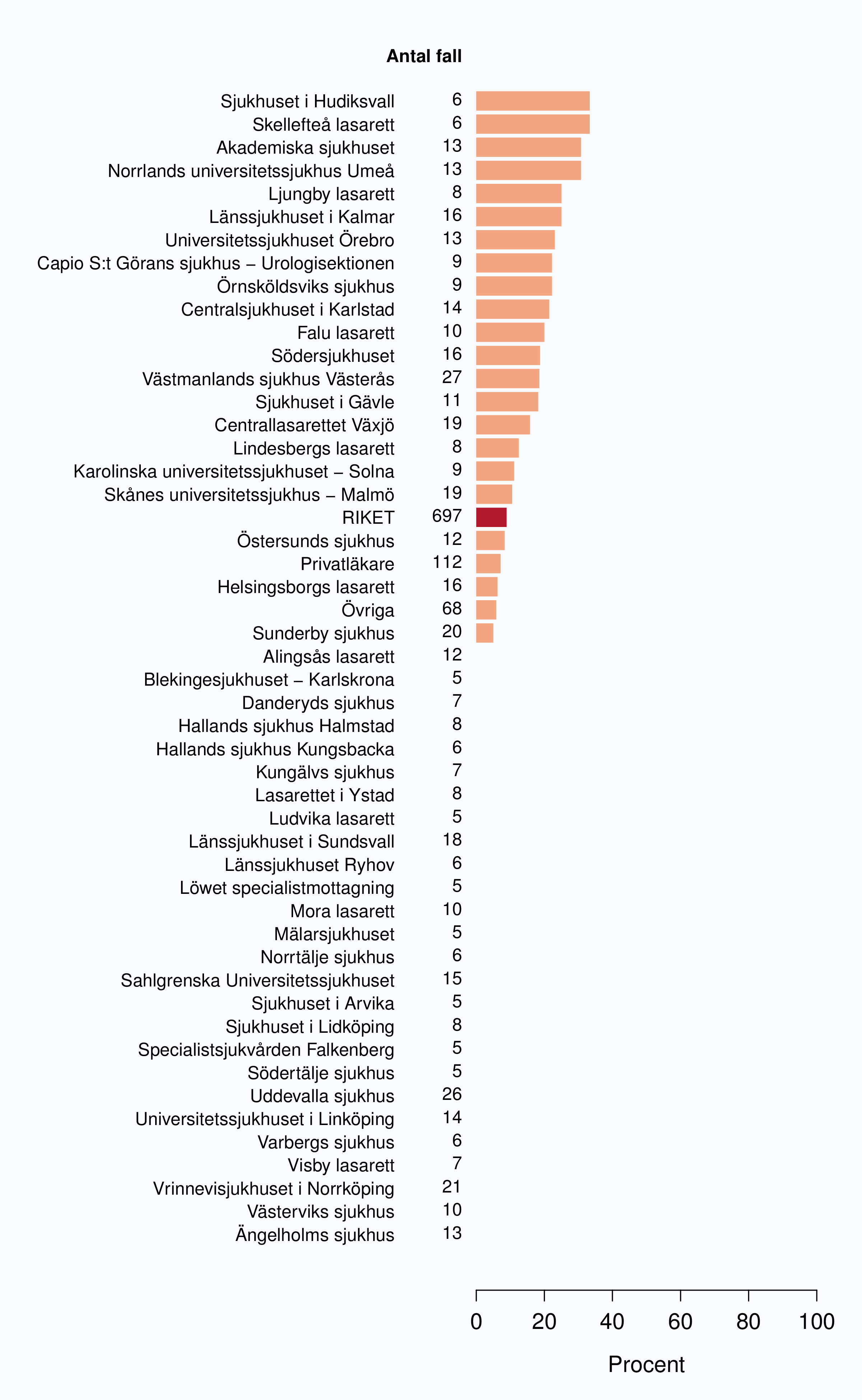
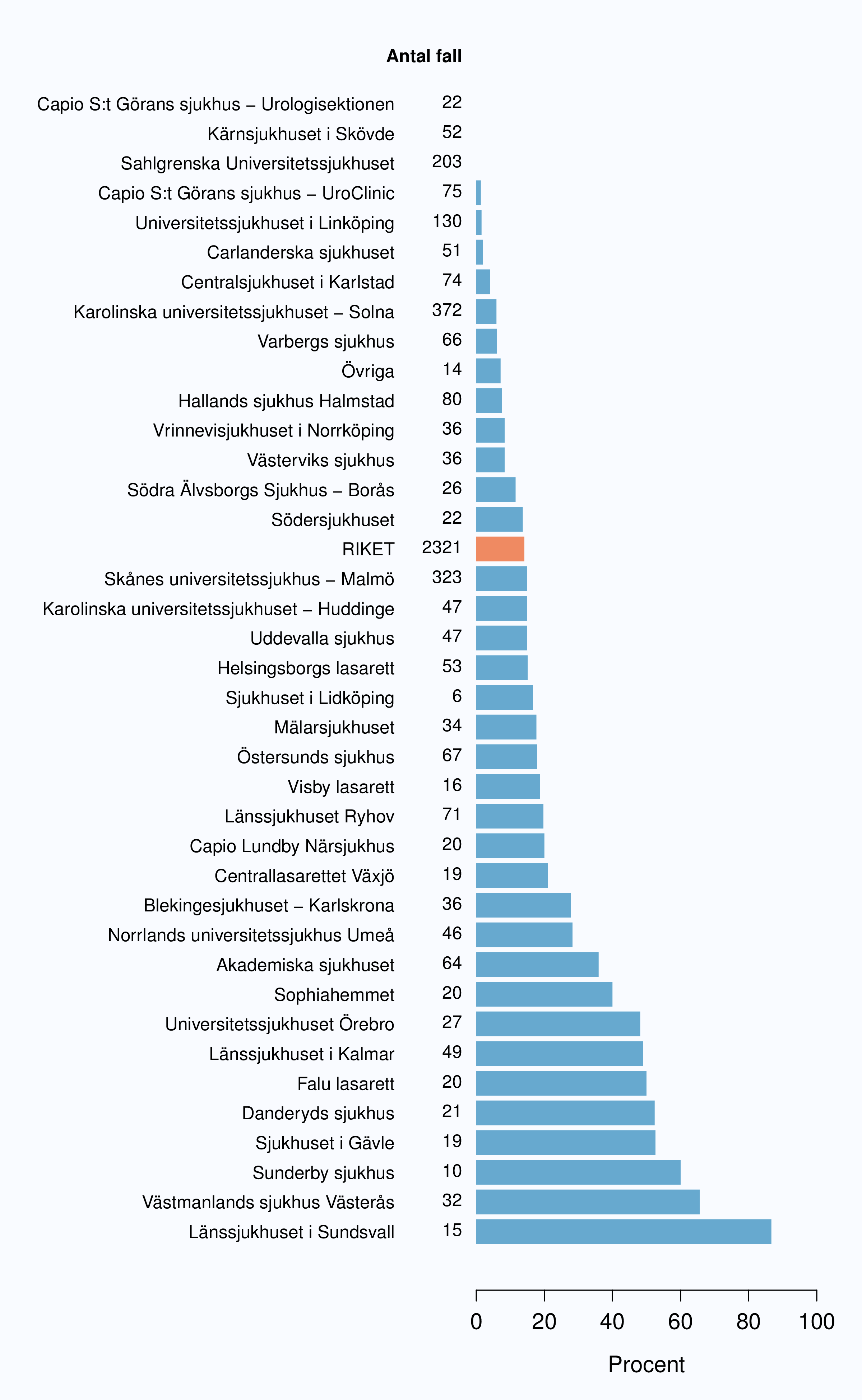
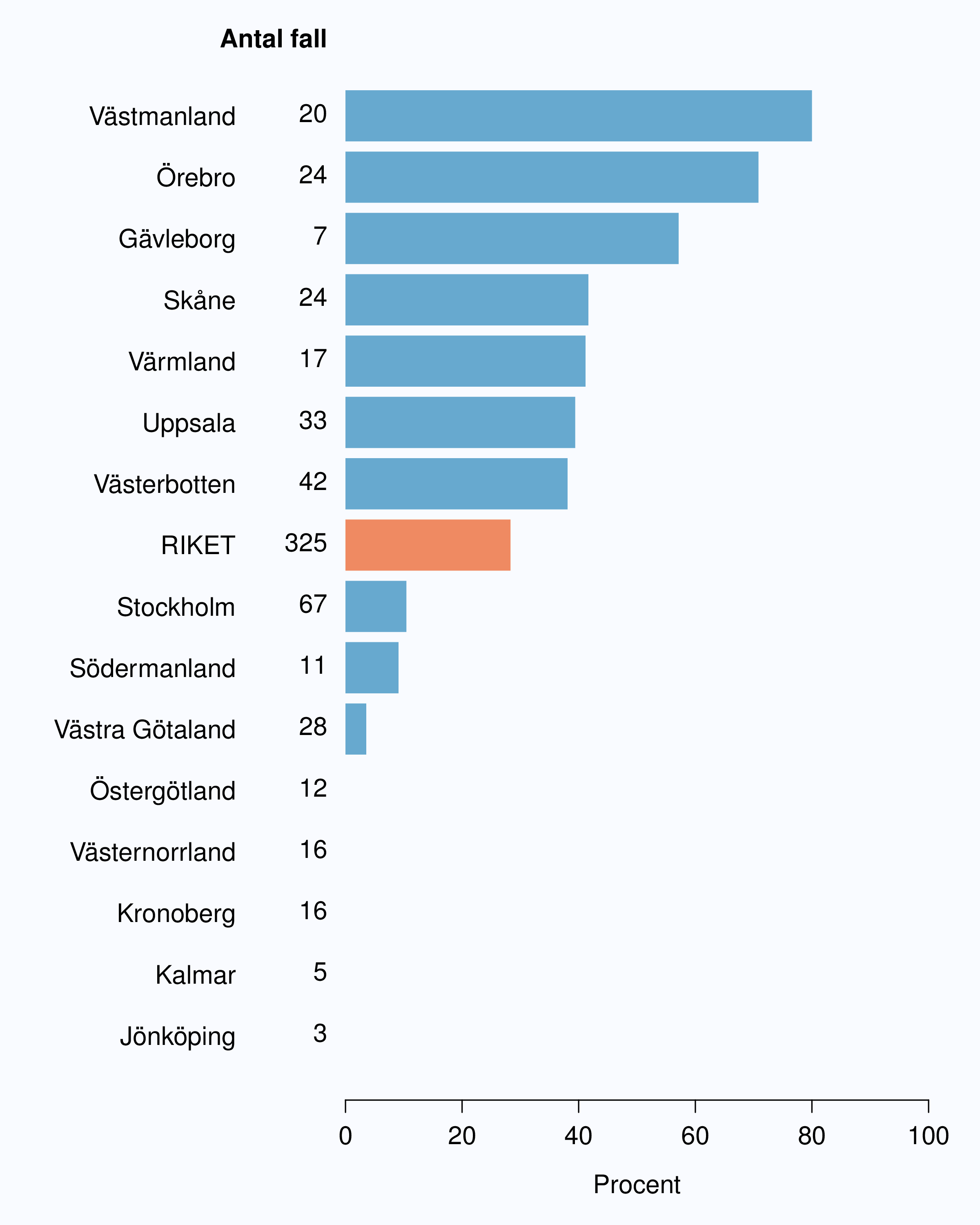
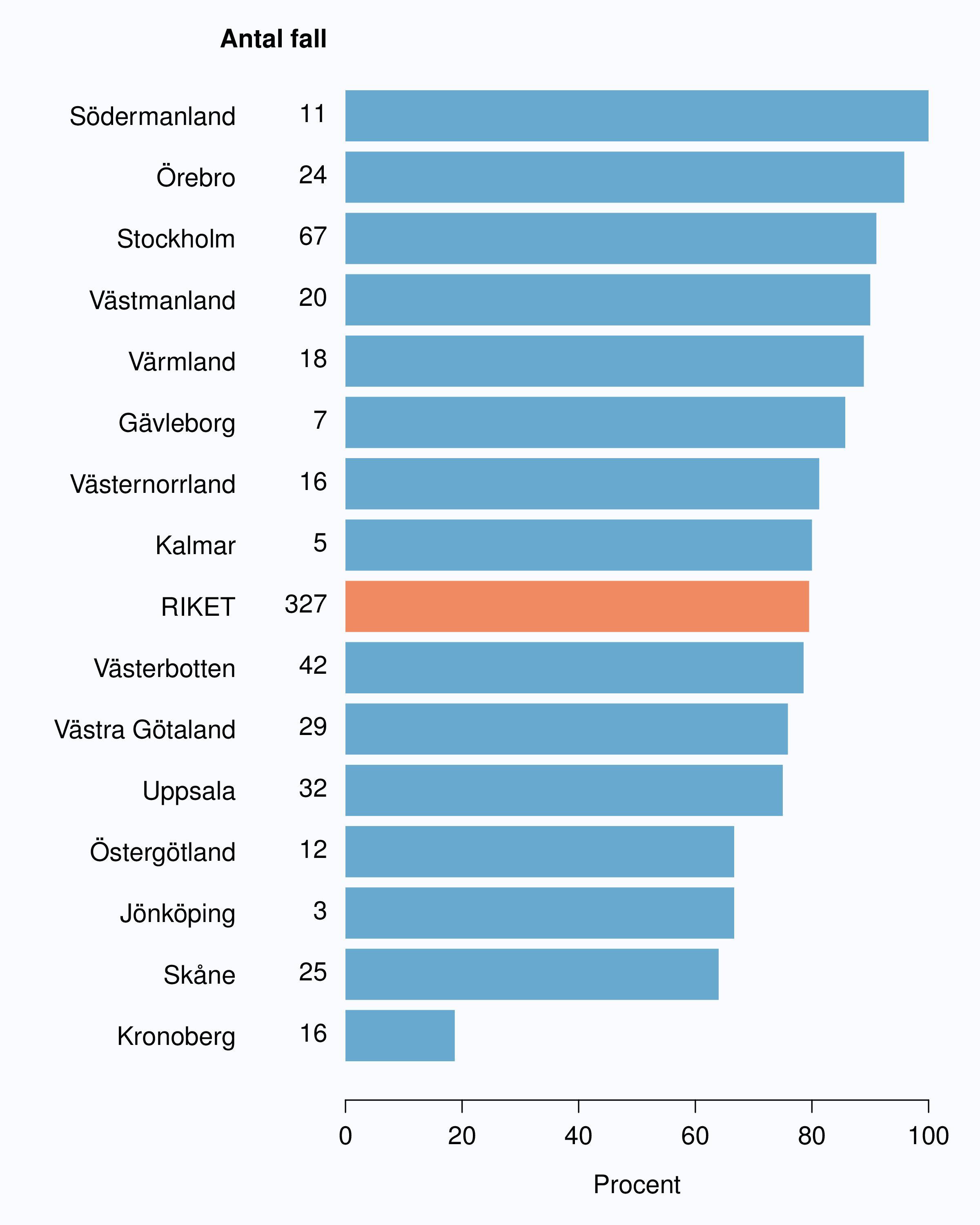
För män med lågrisktumörer är aktiv monitorering den behandlingsstrategi som förordas i de reviderade Riktlinjerna som publicerades i preliminär version 2013, men det finns en mycket stor variation mellan vårdgivare i hur ofta denna strategi tillämpades 2012. Andelen män 65 år eller yngre med lågrisk Pca som behandlades med aktiv monitorering var 54 % i riket och varierade från 39 % till 62 % mellan landstingen i Sverige (Figur 28) och på sjukhusnivå var skillnaderna 13-89 % (Figur 29). Även bland män över 65 år erhöll cirka 60 % aktiv monitorering med stor variationen mellan vårdgivarna (Figur 30 och 31). I sex landsting understeg andelen aktiv monitorering 50 % av män över 65 år med lågrisktumörer. Det är svårt att sätta en exakt målnivå för den stora gruppen lågrisktumörer, som innefattar en tredjedel mycket låg risk, men en nivå på minst 60 % förefaller rimlig. I princip bör alla män i kategorin mycket låg risk cancer ställas på aktiv monitorering eller vid kort förväntad överlevnad symtomstyrd terapi, men på 12 sjukhus understeg den andelen 70 %. Andelen män med mycket låg risk cancer som erhöll aktiv monitorering redovisas per landsting och per sjukhus i figur 32 och 33.
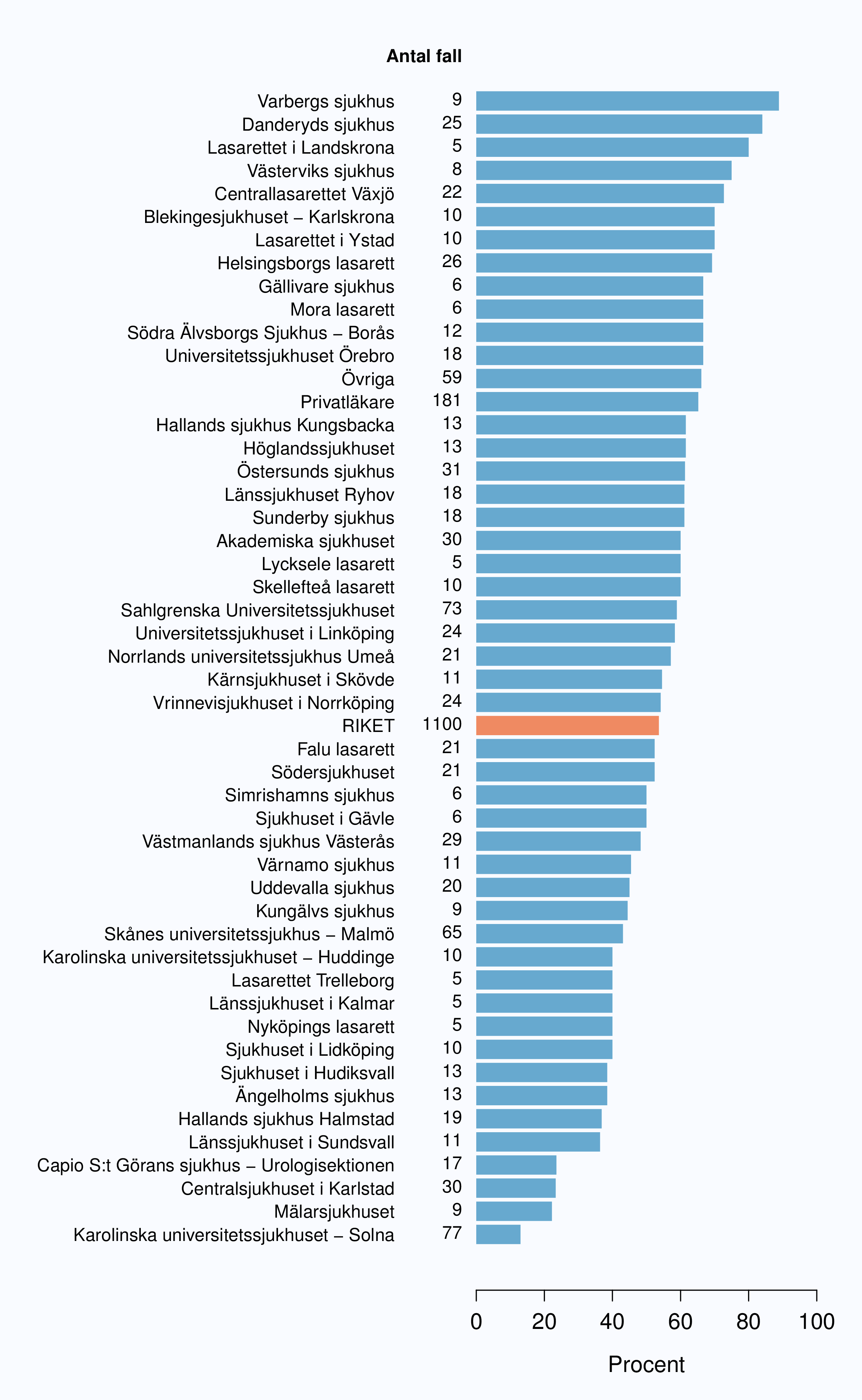
Sjukhus som till figuren bidrog med färre än 5 fall (Löwet specialistmottagning, Norrtälje sjukhus, Södertälje sjukhus, Visby lasarett, Karlskoga lasarett, Kullbergska sjukhuset, Lindesbergs lasarett, Ludvika lasarett, Sjukhuset i Arvika, Sjukhuset i Torsby, Oskarshamns sjukhus, Blekingesjukhuset - Karlshamn, Centralsjukhuset Kristianstad, Ljungby lasarett, Alingsås lasarett, Sjukhuset i Falköping, Sjukhuset i Mariestad, Specialistsjukvården Falkenberg, Södra Älvsborgs Sjukhus - Skene, Kalix sjukhus, Kiruna sjukhus, Piteå älvdals sjukhus, Sollefteå sjukhus, Örnsköldsviks sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Löwet specialistmottagning, Visby lasarett, Kullbergska sjukhuset, Mälarsjukhuset, Sjukhuset i Arvika, Sjukhuset i Bollnäs, Oskarshamns sjukhus, Blekingesjukhuset - Karlshamn, Centralsjukhuset Kristianstad, Sjukhuset i Hässleholm, Sjukhuset i Mariestad, Specialistsjukvården Falkenberg, Södra Älvsborgs Sjukhus - Borås, Kiruna sjukhus, Sollefteå sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Löwet specialistmottagning, Visby lasarett, Karlskoga lasarett, Lindesbergs lasarett, Ludvika lasarett, Nyköpings lasarett, Sjukhuset i Arvika, Sjukhuset i Gävle, Blekingesjukhuset - Karlshamn, Blekingesjukhuset - Karlskrona, Centralsjukhuset Kristianstad, Lasarettet i Landskrona, Lasarettet Trelleborg, Ljungby lasarett, Sjukhuset i Hässleholm, Sjukhuset i Falköping, Sjukhuset i Mariestad, Specialistsjukvården Falkenberg, Kiruna sjukhus, Piteå älvdals sjukhus, Sollefteå sjukhus, Örnsköldsviks sjukhus) har grupperats till "Övriga".
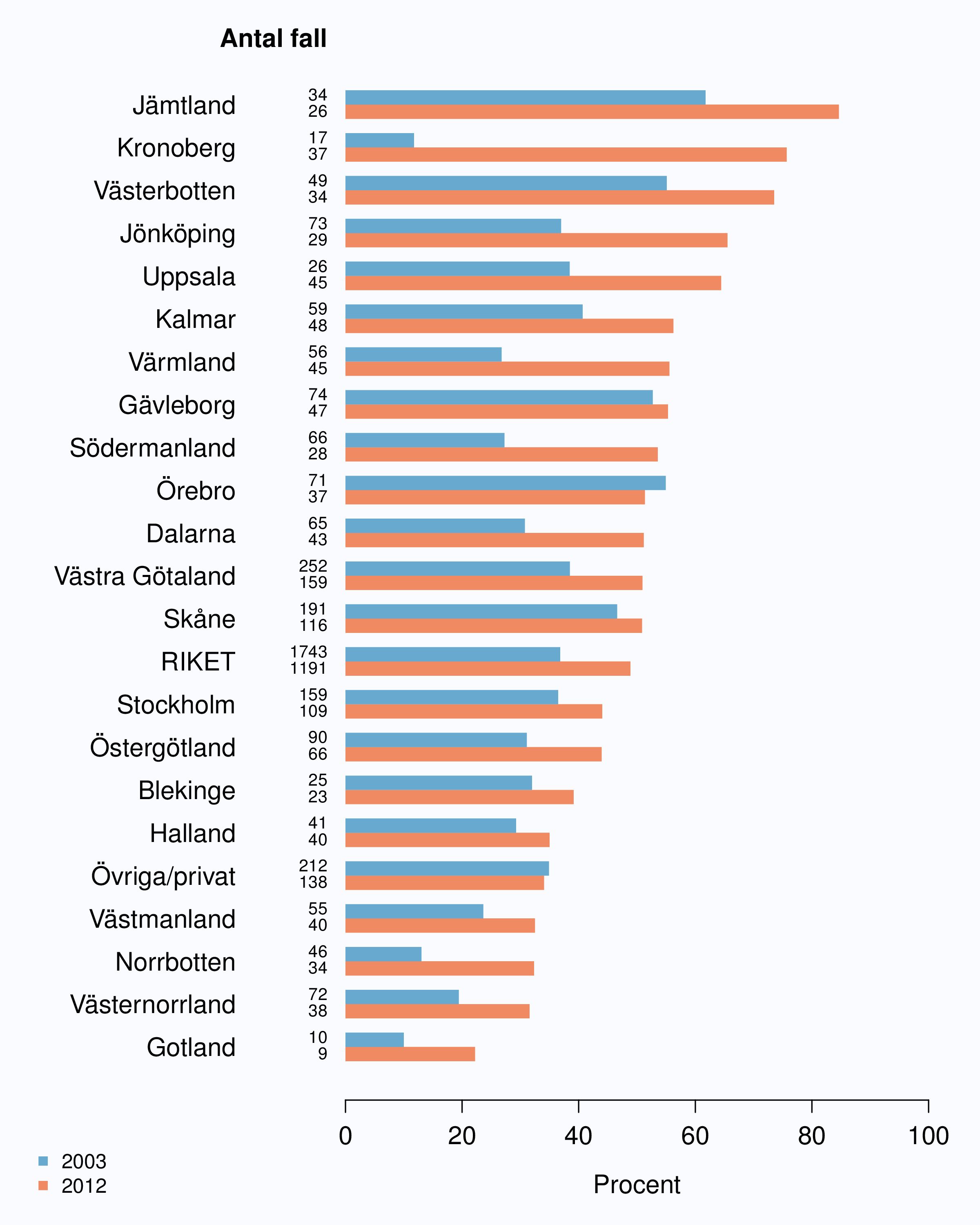
Bland män 75 år och yngre sågs en stor spridning mellan landstingen av andelen män med
intermediär- och högrisktumör som behandlades kurativt, mellan 52 och 94 % respektive 57
och 96 % (Figur 34 och 38). Däremot fanns det en stor skillnad mellan enskilda sjukhus i
andelen män som genomgick kurativ terapi, med en spridning av intermediärrisk mellan 0 och
100 % och för högrisktumörer 43 och 100 % (Figur 35 och 39). Eftersom biologisk och inte
kronologisk ålder avgör behandling ska inte samtliga patienter i denna kategori rekommenderas
kurativ behandling. En del män kan pga. kort förväntad överlevnad vara olämpliga för
kurativt syftande behandling och andra män kan välja aktiv monitorering för att undvika
minskad livskvalitet, och därför är inte 100 procent aktiv behandling i denna grupp ett mål.
Vi vet från tidigare studier att cirka en tredjedel av män som väljer aktiv monitorering
senare får aktiv behandling efter en uppföljningstid på cirka fyra år [9]. Männen som var
äldre än 75 år erhöll kurativt syftande behandling i mycket lägre utsträckning än de yngre
männen, både i intermediärrisk (Figur 36 och 37) och högriskgruppen (Figur 40 och 41).
I NPCR registreras den diagnostiska biopsiomgången, det betyder att för de män som genomgår
ytterligare utredning med utökade biopsier eller bildundersökning av prostata (MR) kommer
behandlingsbeslutet att fattas grundat på detta utökade material men i NPCR redovisas enbart den
primära utredningen. Därför kan data i NPCR vara missvisande på så vis att en grupp av män med
mycket låg risk cancer på primär utredning men där utökad utredning visar en mer utbredd tumör som
visade intermediär eller hög risk cancer förefaller ha fått en behandling som inte följer
Riktlinjerna men i själva verket är korrekt. För att belysa detta införs from 2014 en variabel
som visar om utökad biopsiomgång gjorts, och vi avser att i en efterunderundersökning
belysa hur stor den gruppen och vidare att ta fram dessa PAD-svar. Vidare registreras också
från 2014 om bildundersökning, mestadels MR, av prostata gjorts. Under 2014 kommer
NPCR att pilota en tilläggsblankett där en utvidgad registrering av prostatektomi-data
insamlas.
Sjukhus som till figuren bidrog med färre än 5 fall (Norrtälje sjukhus, Karlskoga lasarett, Lasarettet i Enköping, Ludvika lasarett, Sjukhuset i Bollnäs, Sjukhuset i Torsby, Centralsjukhuset Kristianstad, Kungälvs sjukhus, Sjukhuset i Falköping, Sjukhuset i Mariestad, Kalix sjukhus, Kiruna sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Capio S:t Görans sjukhus - Urologisektionen, Danderyds sjukhus, Karolinska universitetssjukhuset - Solna, Norrtälje sjukhus, Visby lasarett, Centralsjukhuset i Karlstad, Falu lasarett, Karlskoga lasarett, Kullbergska sjukhuset, Lasarettet i Enköping, Lindesbergs lasarett, Mora lasarett, Nyköpings lasarett, Sjukhuset i Arvika, Sjukhuset i Hudiksvall, Sjukhuset i Torsby, Universitetssjukhuset Örebro, Höglandssjukhuset, Västerviks sjukhus, Blekingesjukhuset - Karlshamn, Centralsjukhuset Kristianstad, Lasarettet i Ystad, Lasarettet Trelleborg, Simrishamns sjukhus, Ängelholms sjukhus, Kungälvs sjukhus, Kärnsjukhuset i Skövde, Sjukhuset i Falköping, Sjukhuset i Lidköping, Sjukhuset i Mariestad, Specialistsjukvården Falkenberg, Södra Älvsborgs Sjukhus - Borås, Södra Älvsborgs Sjukhus - Skene, Gällivare sjukhus, Kiruna sjukhus, Lycksele lasarett, Örnsköldsviks sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Löwet specialistmottagning, Kullbergska sjukhuset, Nyköpings lasarett, Sjukhuset i Arvika, Sjukhuset i Bollnäs, Sjukhuset i Torsby, Blekingesjukhuset - Karlshamn, Lasarettet i Landskrona, Sjukhuset i Hässleholm, Sjukhuset i Falköping, Sjukhuset i Mariestad, Specialistsjukvården Falkenberg, Södra Älvsborgs Sjukhus - Skene, Kalix sjukhus, Kiruna sjukhus, Lycksele lasarett, Piteå älvdals sjukhus, Örnsköldsviks sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Karolinska universitetssjukhuset - Huddinge, Karlskoga lasarett, Kullbergska sjukhuset, Lasarettet i Enköping, Nyköpings lasarett, Sjukhuset i Bollnäs, Sjukhuset i Torsby, Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Blekingesjukhuset - Karlshamn, Centralsjukhuset Kristianstad, Lasarettet i Landskrona, Lasarettet Trelleborg, Simrishamns sjukhus, Kärnsjukhuset i Skövde, Sjukhuset i Falköping, Södra Älvsborgs Sjukhus - Borås, Södra Älvsborgs Sjukhus - Skene, Gällivare sjukhus, Kalix sjukhus, Kiruna sjukhus, Lycksele lasarett, Piteå älvdals sjukhus, Sollefteå sjukhus) har grupperats till "Övriga".
För att utvärdera optimal uppföljningsstrategi vid aktiv monitorering har en klinisk studie startats, SAMS – Studie om Aktiv Monitorering i Sverige (PI Ola Bratt, Helsingborg). I studien jämförs traditionell uppföljning med PSA-testning och re-biopsier med ett protokoll där extensiv re-biopsi görs omedelbart efter diagnostisk biopsi och sedan följs patienten med enbart PSA-kontroller. Primär endpoint är konvertering till aktiv terapi, dvs. operation eller strålbehandling. För de patienter som inte kan randomiseras finns en observationsstudie i SAMS. Vi tror att SAMS kan medföra att uppföljning vid aktiv monitorering harmoniseras, så att uppföljning och val av tidpunkt för aktiv behandling blir mer likartat i landet. SAMS är en studie där studieformulären är upplagda i INCA, vilket medför att kostnaden för SAMS-studien blir låg och SAMS är en pilotstudie för att använda INCA för kliniska studier.
Operationsteknik
Radikal prostatektomi utförs med retropubisk teknik (öppen kirurgi), med laparoskopisk teknik eller
som robotassisterad laparoskopisk prostatektomi (RALP). Sedan 1998 har antalet utförda
prostatektomier ökat från 450 till 2 590 operationer år 2011 (Tabell 8). I Patientregistret särskiljs
endoskopiska prostatektomier från retropubiska, men RALP har ingen egen operationskod.
RALP- operationerna ökar kraftigt på bekostnad av öppen operation. År 2012 utfördes 1 180
operationer som RALP, dvs. mer än hälften av alla prostatektomier, och dessa ingrepp skedde på elva
sjukhus. I den Norra sjukvårdsregionen utfördes inga RALP, men i övriga sjukvårdsregioner
hade ett eller flera sjukhus tillgång till operationsrobot och vid dessa sjukhus dominerade
denna operationstyp (Tabell 10). Under 2013 inköpte ytterligare ett antal sjukhus i landet
operationsrobotsystem, så nu finns det operationsrobotsystem i alla sex regioner i Sverige.
Antalet utförda ingrepp varierade stort mellan vårdgivare, från enstaka prostatektomier till mer än 300
ingrepp på två sjukhus under 2012. Det är framförallt för RALP som det skett en koncentration
till ett fåtal kliniker med stora operationsvolymer och vid fyra sjukhus utfördes mer än
100 RALP under 2012. Vid 21 sjukhus utfördes mindre än 36 ingrepp, dvs. mindre än tre
prostatektomier per månad (Figur 42). I figur 42 visas antal ingrepp utförda per sjukhus under åren
2009-2012.
| |
Retropubisk |
Laparoskopisk |
Robotassisterad laparoskopisk |
Laparoskopisk/robotassisterad |
Totalt |
| Diagnosår | |||||
| 1998 | 450 (100) | 0 (0) | 450 | ||
| 1999 | 655 (100) | 0 (0) | 655 | ||
| 2000 | 735 (98) | 12 (2) | 747 | ||
| 2001 | 869 (95) | 49 (5) | 918 | ||
| 2002 | 1021 (89) | 126 (11) | 1147 | ||
| 2003 | 1329 (84) | 244 (16) | 1573 | ||
| 2004 | 1789 (85) | 328 (15) | 2117 | ||
| 2005 | 1677 (78) | 486 (22) | 2163 | ||
| 2006 | 1419 (72) | 558 (28) | 1977 | ||
| 2008 | 1242 (55) | 122 (5) | 885 (39) | 1007 (45) | 2249 |
| 2009 | 1338 (48) | 123 (4) | 1326 (48) | 1449 (52) | 2787 |
| 2010 | 1201 (49) | 112 (5) | 1151 (47) | 1263 (51) | 2464 |
| 2011 | 1060 (41) | 135 (5) | 1395 (54) | 1530 (59) | 2590 |
| 2012 | 758 (37) | 92 (5) | 1180 (58) | 1272 (63) | 2030 |
Uppgiften är ej tillgänglig för Stockholm år 2007, och detta år exkluderas därför från tabellen.
| |
Retropubisk |
Laparoskopisk |
Robotassisterad laparoskopisk |
Totalt |
Antal RP i PaR1 |
| Behandlingsår | |||||
| 2009 | 1266 (50) | 98 (4) | 1156 (46) | 2520 | 2617 |
| 2010 | 1249 (48) | 124 (5) | 1223 (47) | 2596 | 2665 |
| 2011 | 1150 (45) | 118 (5) | 1311 (51) | 2579 | 2889 |
| 2012 | 861 (37) | 113 (5) | 1347 (58) | 2321 | |
1 Antal radikala prostatektomier i Patientregistret (PaR) för aktuellt behandlingsår (avser både primär och sekundär terapi).
| |
Retropubisk |
Laparoskopisk |
Robotassisterad laparoskopisk |
Totalt |
| Stockholm-Gotland | ||||
| Capio S:t Görans sjukhus - UroClinic | 0 (0) | 0 (0) | 75 (100) | 75 |
| Capio S:t Görans sjukhus - Urologisektionen | 0 (0) | 0 (0) | 22 (100) | 22 |
| Danderyds sjukhus | 21 (100) | 0 (0) | 0 (0) | 21 |
| Karolinska universitetssjukhuset - Huddinge | 47 (100) | 0 (0) | 0 (0) | 47 |
| Karolinska universitetssjukhuset - Solna | 0 (0) | 2 (1) | 370 (99) | 372 |
| Sophiahemmet | 11 (55) | 9 (45) | 0 (0) | 20 |
| Södersjukhuset | 22 (100) | 0 (0) | 0 (0) | 22 |
| Visby lasarett | 16 (100) | 0 (0) | 0 (0) | 16 |
| Uppsala-Örebro | ||||
| Akademiska sjukhuset | 18 (28) | 45 (70) | 1 (2) | 64 |
| Centralsjukhuset i Karlstad | 10 (14) | 9 (12) | 55 (74) | 74 |
| Falu lasarett | 20 (100) | 0 (0) | 0 (0) | 20 |
| Mälarsjukhuset | 0 (0) | 34 (100) | 0 (0) | 34 |
| Sjukhuset i Gävle | 19 (100) | 0 (0) | 0 (0) | 19 |
| Universitetssjukhuset Örebro | 26 (96) | 1 (4) | 0 (0) | 27 |
| Västmanlands sjukhus Västerås | 32 (100) | 0 (0) | 0 (0) | 32 |
| Sydöstra | ||||
| Länssjukhuset i Kalmar | 49 (100) | 0 (0) | 0 (0) | 49 |
| Länssjukhuset Ryhov | 25 (35) | 3 (4) | 43 (61) | 71 |
| Universitetssjukhuset i Linköping | 0 (0) | 0 (0) | 130 (100) | 130 |
| Vrinnevisjukhuset i Norrköping | 35 (97) | 0 (0) | 1 (3) | 36 |
| Västerviks sjukhus | 36 (100) | 0 (0) | 0 (0) | 36 |
| Övriga | 3 (43) | 0 (0) | 4 (57) | 7 |
| Södra | ||||
| Blekingesjukhuset - Karlskrona | 36 (100) | 0 (0) | 0 (0) | 36 |
| Centrallasarettet Växjö | 10 (53) | 1 (5) | 8 (42) | 19 |
| Hallands sjukhus Halmstad | 3 (4) | 1 (1) | 76 (95) | 80 |
| Helsingsborgs lasarett | 46 (87) | 0 (0) | 7 (13) | 53 |
| Skånes universitetssjukhus - Malmö | 22 (7) | 5 (2) | 296 (92) | 323 |
| Övriga | 0 (0) | 0 (0) | 1 (100) | 1 |
| Västra | ||||
| Capio Lundby Närsjukhus | 20 (100) | 0 (0) | 0 (0) | 20 |
| Carlanderska sjukhuset | 51 (100) | 0 (0) | 0 (0) | 51 |
| Kärnsjukhuset i Skövde | 51 (98) | 1 (2) | 0 (0) | 52 |
| Sahlgrenska Universitetssjukhuset | 6 (3) | 0 (0) | 197 (97) | 203 |
| Sjukhuset i Lidköping | 6 (100) | 0 (0) | 0 (0) | 6 |
| Södra Älvsborgs Sjukhus - Borås | 26 (100) | 0 (0) | 0 (0) | 26 |
| Uddevalla sjukhus | 47 (100) | 0 (0) | 0 (0) | 47 |
| Varbergs sjukhus | 3 (5) | 2 (3) | 61 (92) | 66 |
| Övriga | 6 (100) | 0 (0) | 0 (0) | 6 |
| Norra | ||||
| Länssjukhuset i Sundsvall | 15 (100) | 0 (0) | 0 (0) | 15 |
| Norrlands universitetssjukhus Umeå | 46 (100) | 0 (0) | 0 (0) | 46 |
| Sunderby sjukhus | 10 (100) | 0 (0) | 0 (0) | 10 |
| Östersunds sjukhus | 67 (100) | 0 (0) | 0 (0) | 67 |
| RIKET | ||||
| Totalt | 861 (37) | 113 (5) | 1347 (58) | 2321 |
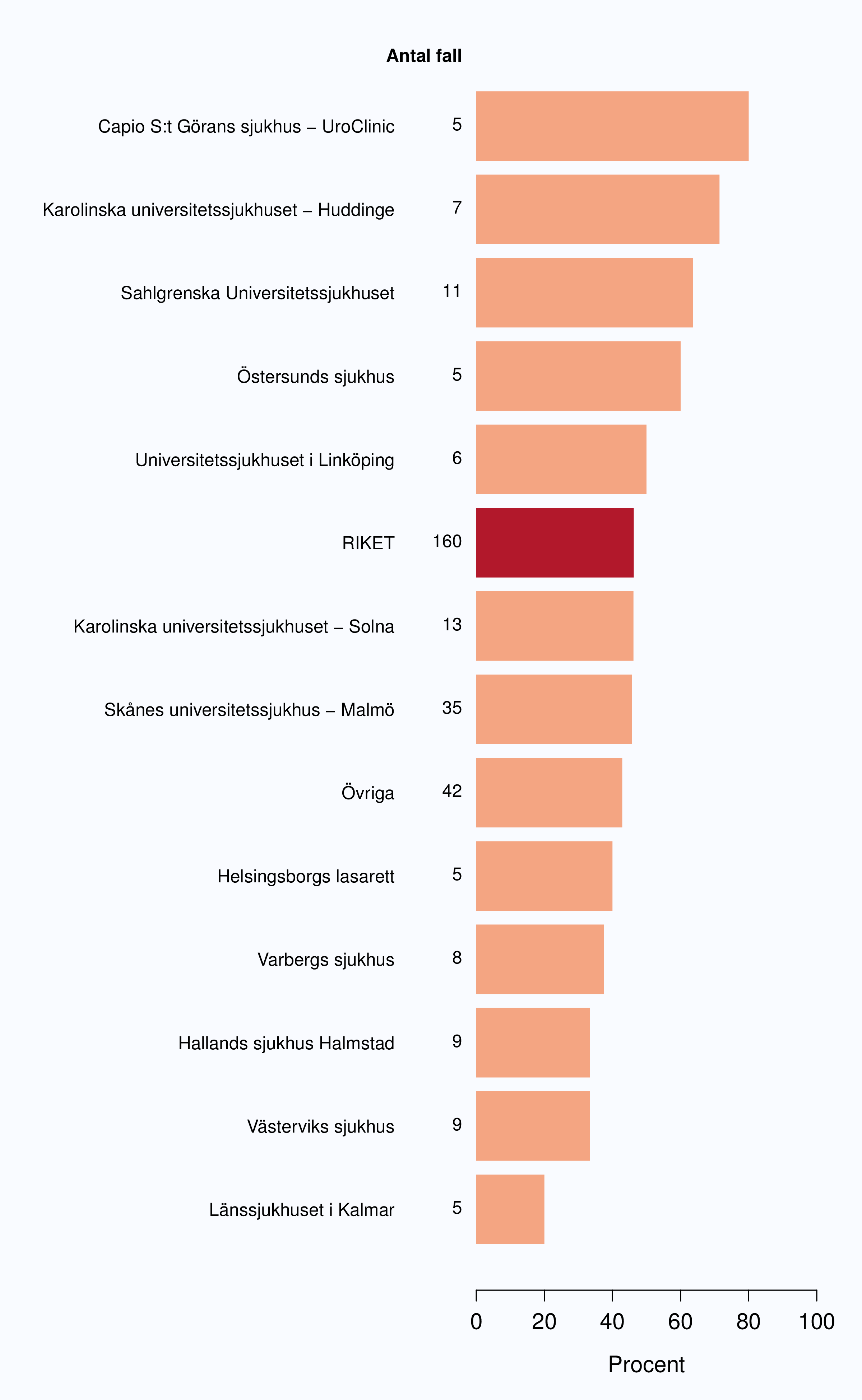
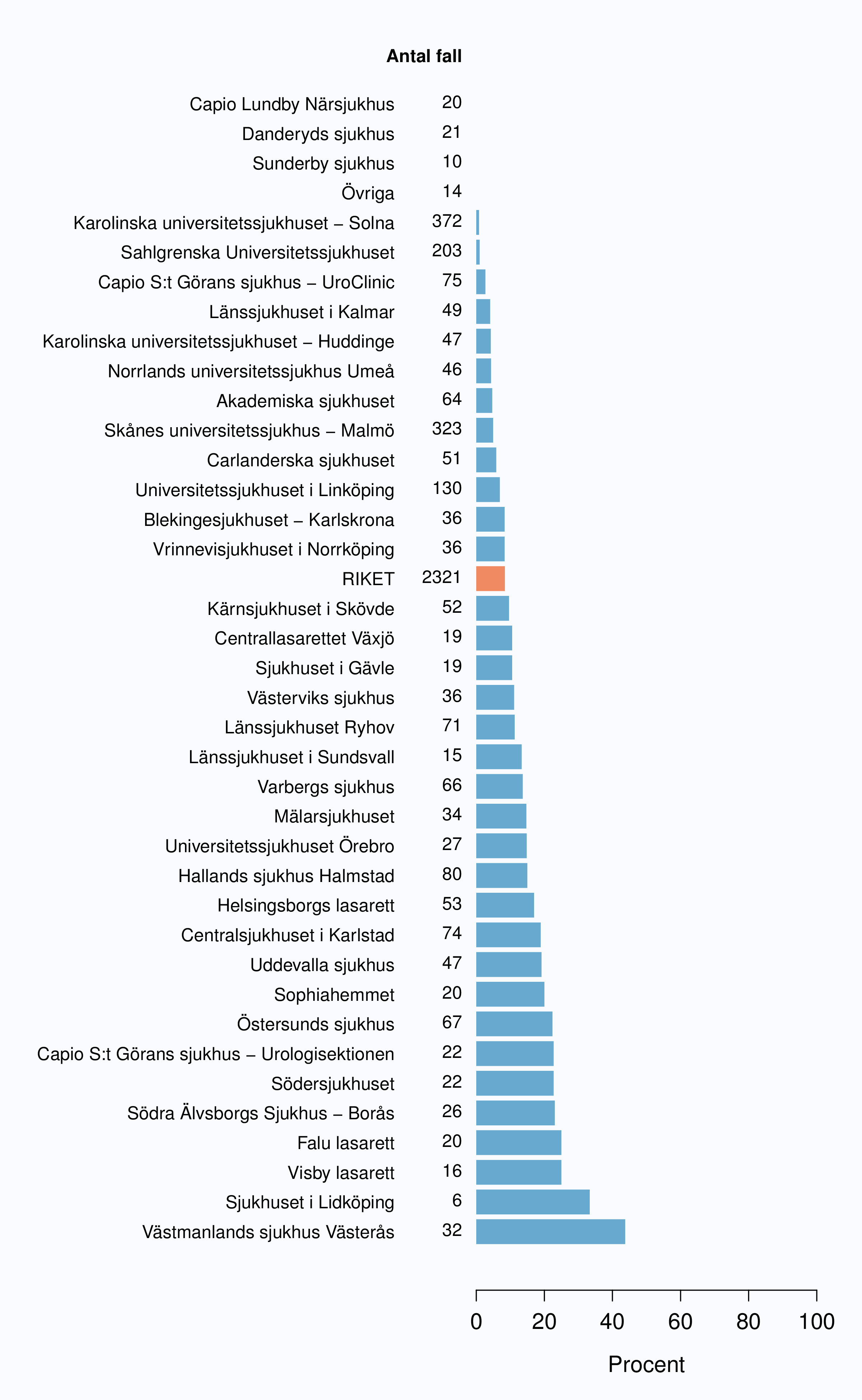
Sjukhus som till tabellen bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
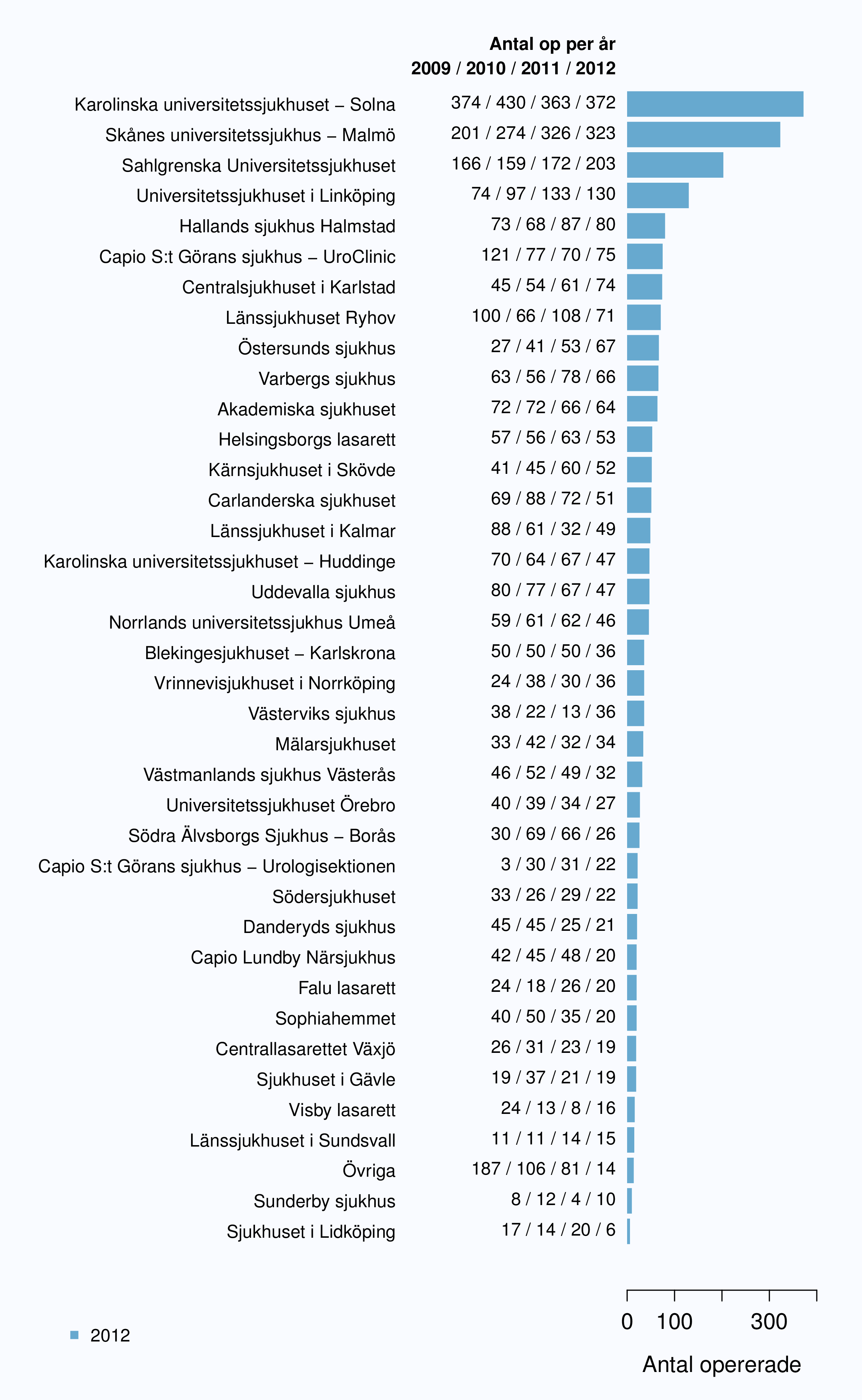
Totalt genomfördes 2321 operationer under 2012, varav 898 (38.7 %) på de tre sjukhusen med störst volym.
Sjukhus som till figuren bidrog med färre än 5 fall år 2012 (Alingsås lasarett, Alingsås lasarett, Centralsjukhuset Kristianstad, Höglandssjukhuset, Höglandssjukhuset, Kullbergska sjukhuset, Kungälvs sjukhus, Kungälvs sjukhus, Lasarettet i Landskrona, Nyköpings lasarett, Oskarshamns sjukhus, Oskarshamns sjukhus, Simrishamns sjukhus, Simrishamns sjukhus, Sjukhuset i Mariestad, Skånes universitetssjukhus - Lund, Specialistsjukvården Falkenberg, Värnamo sjukhus, Värnamo sjukhus, Ängelholms sjukhus, Övriga) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Nervsparande intention
Den vanligaste långtidsbiverkan efter radikal prostatektomi är erektil dysfunktion, som beror på att de
nerver som ansvarar för erektionen ofta skadas vid operationen, eftersom nerverna passerar
prostata ner till penis. Dessa autonoma nerver är mycket känsliga för all typ av påverkan.
Risken för erektil dysfunktion ökar med patientens ålder och med tumörens lokala utbredning och den
är också relaterad till operationsteknik och operatörens förtrogenhet med tekniken. Det finns en
mycket stor spridning av den rapporterade frekvensen av erektil dysfunktion efter operation. Det anges
i litteraturen att 19-67 % av männen drabbas av erektil dysfunktion efter öppen kirurgi och 3-31 % av
männen efter robotassisterad kirurgi [10]. Den näst vanligaste och mest handikappande biverkan utgörs
av urinläckage som uppstår i 2-34 % av alla prostatektomier enligt rapporter i litteraturen [10].
Operationen kan göras med nervsparande teknik, dvs. man fridissekerar och lämnar nervbuntarna
intakta på ena sidan (unilateralt) eller bägge sidorna (bilateralt) vid lågrisktumörer där risken är liten
för extrakapsulär växt och positiv marginal, dvs. tumörväxt i operationspreparatets ytterkant. I
registrering i NPCR skall anges om man preoperativt planerade att spara nerverna, på ena eller bägge
sidorna vid operation, vilket är aktuellt om tumören är liten och har låg Gleasonsumma.
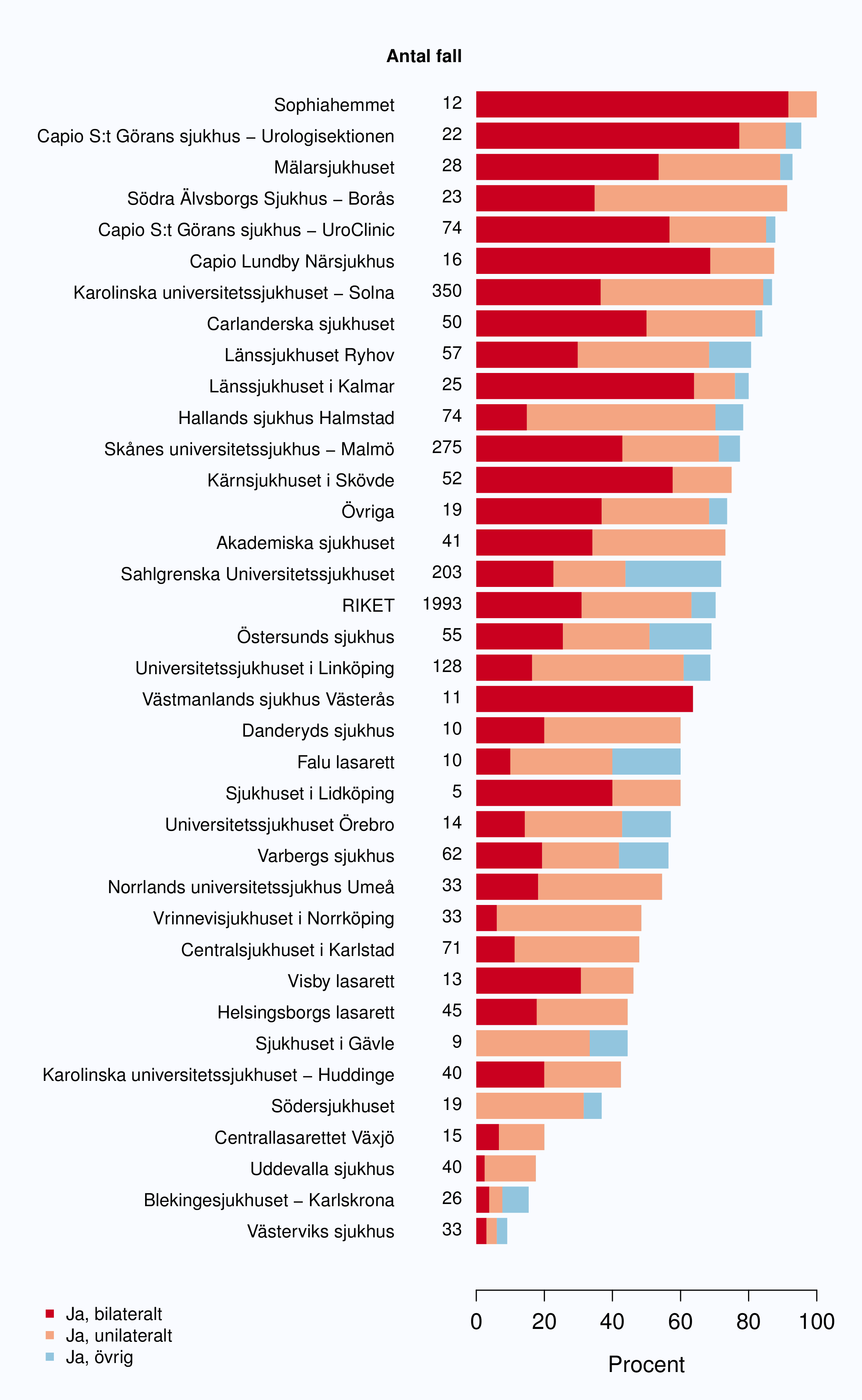
Andelen operationer där man hade nervsparande intention på en eller bägge sidor var likartad 2009-
2012 (Tabell 11). Som förväntat kunde man också se en tydligt mindre andel operationer med
nervsparande intention i gruppen med högrisktumörer jämfört med lågrisktumörer (Tabell 12). Uppgift
om nervsparande intention saknades i 14 % av alla ingrepp i landet och det fanns en stor spridning i
hur stor andel som saknade denna uppgift från mindre än 10 % till mer än 70 % per sjukhus,
på åtta sjukhus saknades uppgiften för mer än 40 % av de opererade fallen (Figur 44).
Det fanns också en mycket stor variation i hur ofta man planerade en nervsparande teknik på ena eller
bägge sidorna mellan sjukhusen i landet, vilket varierade mellan mindre än 10 % upp till 100 % (Figur
45). Skillnaden mellan alla ingrepp och enbart lågrisktumör (Figur 46) var förvånansvärt liten, 70 %
för samtliga tumörer och 85 % för lågrisktumörer.
| |
Ja, bilateralt |
Ja, unilateralt |
Ja, övrig |
Nej |
Uppgift saknas |
Totalt |
| Behandlingsår | ||||||
| 2009 | 752 (30) | 722 (29) | 35 (1) | 731 (29) | 280 (11) | 2520 |
| 2010 | 753 (29) | 757 (29) | 59 (2) | 702 (27) | 325 (13) | 2596 |
| 2011 | 703 (27) | 733 (28) | 183 (7) | 631 (24) | 329 (13) | 2579 |
| 2012 | 617 (27) | 643 (28) | 141 (6) | 592 (26) | 328 (14) | 2321 |
| |
Ja, bilateralt |
Ja, unilateralt |
Ja, övrig |
Nej |
Uppgift saknas |
Totalt |
| Riskkategori | ||||||
| 1. Lågrisk | 298 (44) | 164 (24) | 38 (6) | 98 (14) | 78 (12) | 676 |
| 2. Intermediärrisk | 272 (22) | 400 (33) | 87 (7) | 307 (25) | 162 (13) | 1228 |
| 3. Högrisk | 32 (10) | 66 (20) | 14 (4) | 154 (47) | 61 (19) | 327 |
Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om nervsparande intention ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Alingsås lasarett, Kungälvs sjukhus, Länssjukhuset i Sundsvall, Sunderby sjukhus) har grupperats till "Övriga".
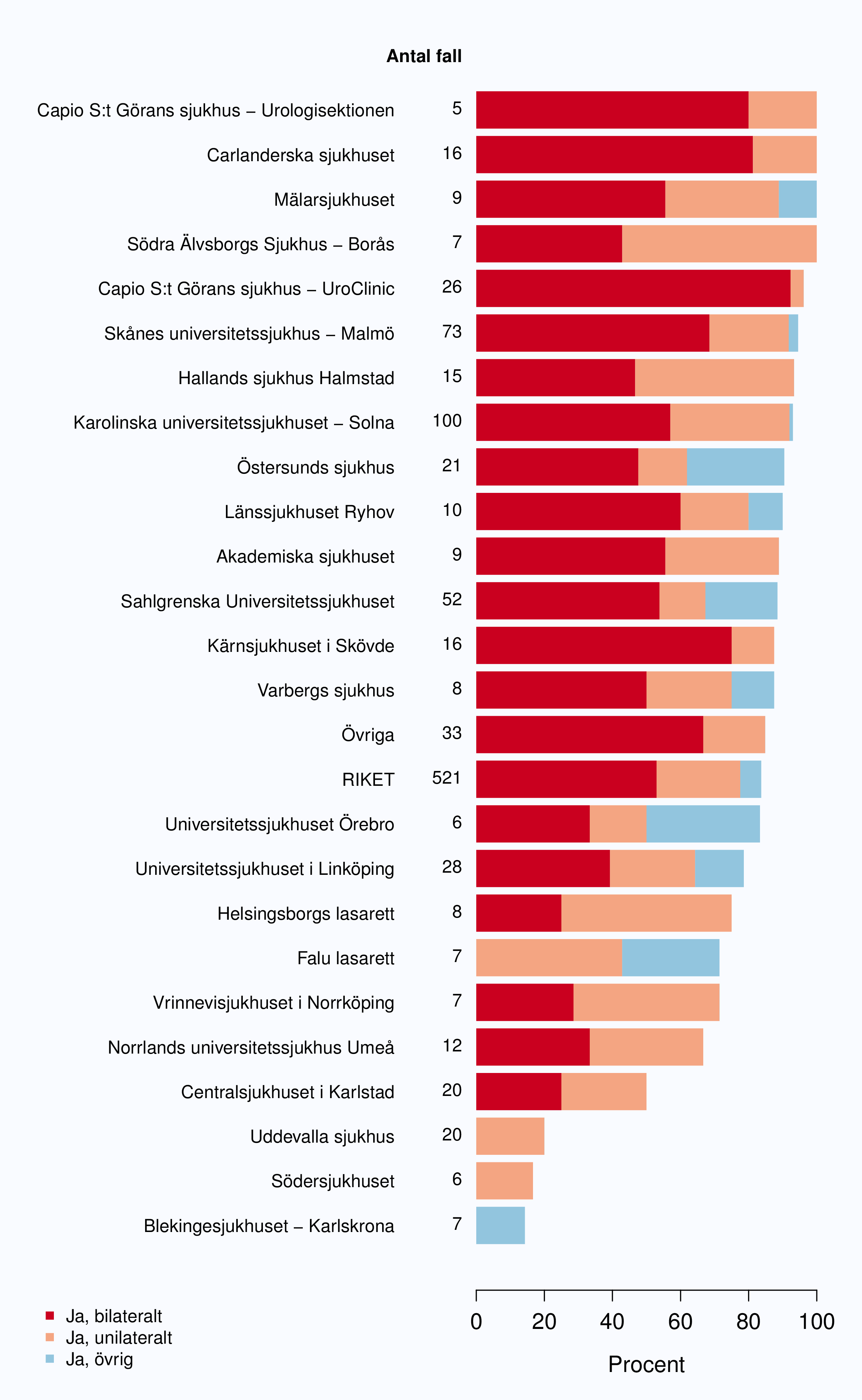
Bland de män där uppgift om nervsparande intention ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Danderyds sjukhus, Karolinska universitetssjukhuset - Huddinge, Sophiahemmet, Visby lasarett, Sjukhuset i Gävle, Västmanlands sjukhus Västerås, Höglandssjukhuset, Länssjukhuset i Kalmar, Västerviks sjukhus, Centrallasarettet Växjö, Alingsås lasarett, Capio Lundby Närsjukhus, Sjukhuset i Lidköping, Sunderby sjukhus) har grupperats till "Övriga".
Tumörstadium
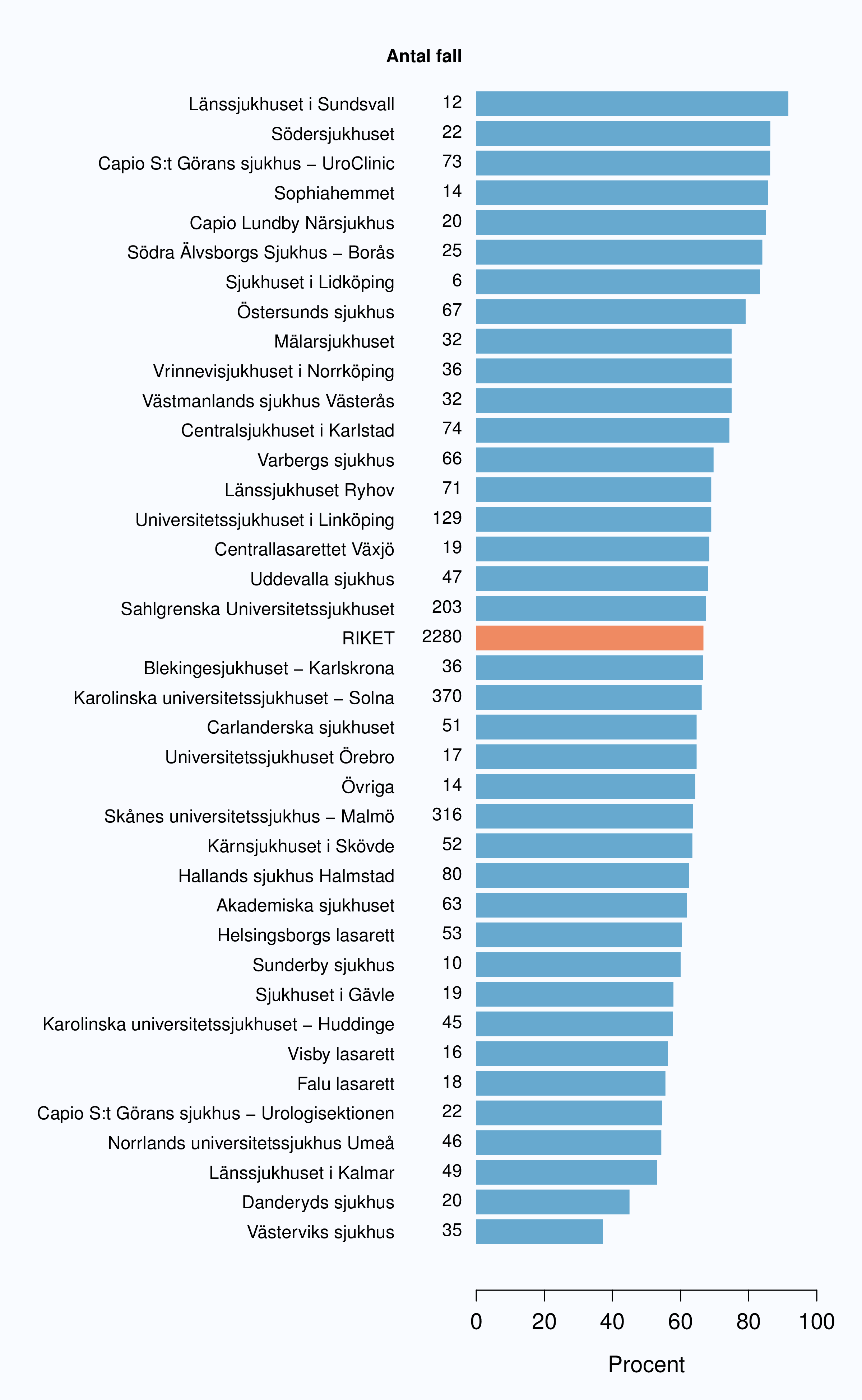
Två tredjedelar av de bortopererade tumörerna bedömdes vid histopatologisk undersökning (PAD) som
pT2, dvs. tumörens växt var begränsad av prostatakapseln (Tabell 13). Den uppgiften saknades för
mer än 20 % av de opererade fallen på tre sjukhus (Figur 47). Andelen pT2 varierade stort
mellan opererande sjukhus (37-92 %) (Figur 48). Som förväntat var andelen pT2-tumörer
högre i gruppen som preoperativt bedömdes vara en lågrisktumör, dvs. kliniskt stadium
T1c, Gleasonsumma 6 eller lägre och PSA lägre än 20 μg/L än högre riskkategori (Figur
49-51).

Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om pT-stadium ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om pT-stadium ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Karolinska universitetssjukhuset - Huddinge, Sophiahemmet, Visby lasarett, Höglandssjukhuset, Länssjukhuset i Kalmar, Västerviks sjukhus, Centrallasarettet Växjö, Alingsås lasarett, Sjukhuset i Lidköping, Sunderby sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om pT-stadium ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Sophiahemmet, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) har grupperats till "Övriga".
Bland de män där uppgift om pT-stadium ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Capio S:t Görans sjukhus - Urologisektionen, Sophiahemmet, Södersjukhuset, Visby lasarett, Akademiska sjukhuset, Sjukhuset i Gävle, Västmanlands sjukhus Västerås, Höglandssjukhuset, Länssjukhuset Ryhov, Vrinnevisjukhuset i Norrköping, Blekingesjukhuset - Karlskrona, Centrallasarettet Växjö, Carlanderska sjukhuset, Kärnsjukhuset i Skövde, Sjukhuset i Lidköping, Södra Älvsborgs Sjukhus - Borås, Uddevalla sjukhus, Norrlands universitetssjukhus Umeå, Sunderby sjukhus) har grupperats till "Övriga".
Positiv marginal
Positiv marginal innebär att det finns tumörvävnad i resektionsranden i preparatet vid
patologbedömning, dvs. en icke-radikal exstirpation av tumören. Positiv marginal medför en ökad
risk för PSA-relaps, dvs. att tumören återkommer och kan detekteras med PSA-prov och
det finns också en ökad risk för klinisk relaps. Det finns dock mycket stora variationer i
risken för progress beroende på var tumören växte ut i preparatkanten och hur stor den
positiva marginalen var. Om patologen uttryckte tveksamhet anges ”osäker” i registreringen.
Frekvensen positiv marginal kommer alltså att vara relaterad till tumörens storlek, aggressivitet och
riskkategori, dvs. case mix, operationsteknik, patologens noggrannhet vid undersökning av preparatet
och till sist bedömningen av PAD-svaret och rapporten till registret. Om patologbedömningen är
standardiserad och av god kvalitet så är andelen positiv marginal i en operationsserie ett gott indirekt
mått på operationskvalitet.
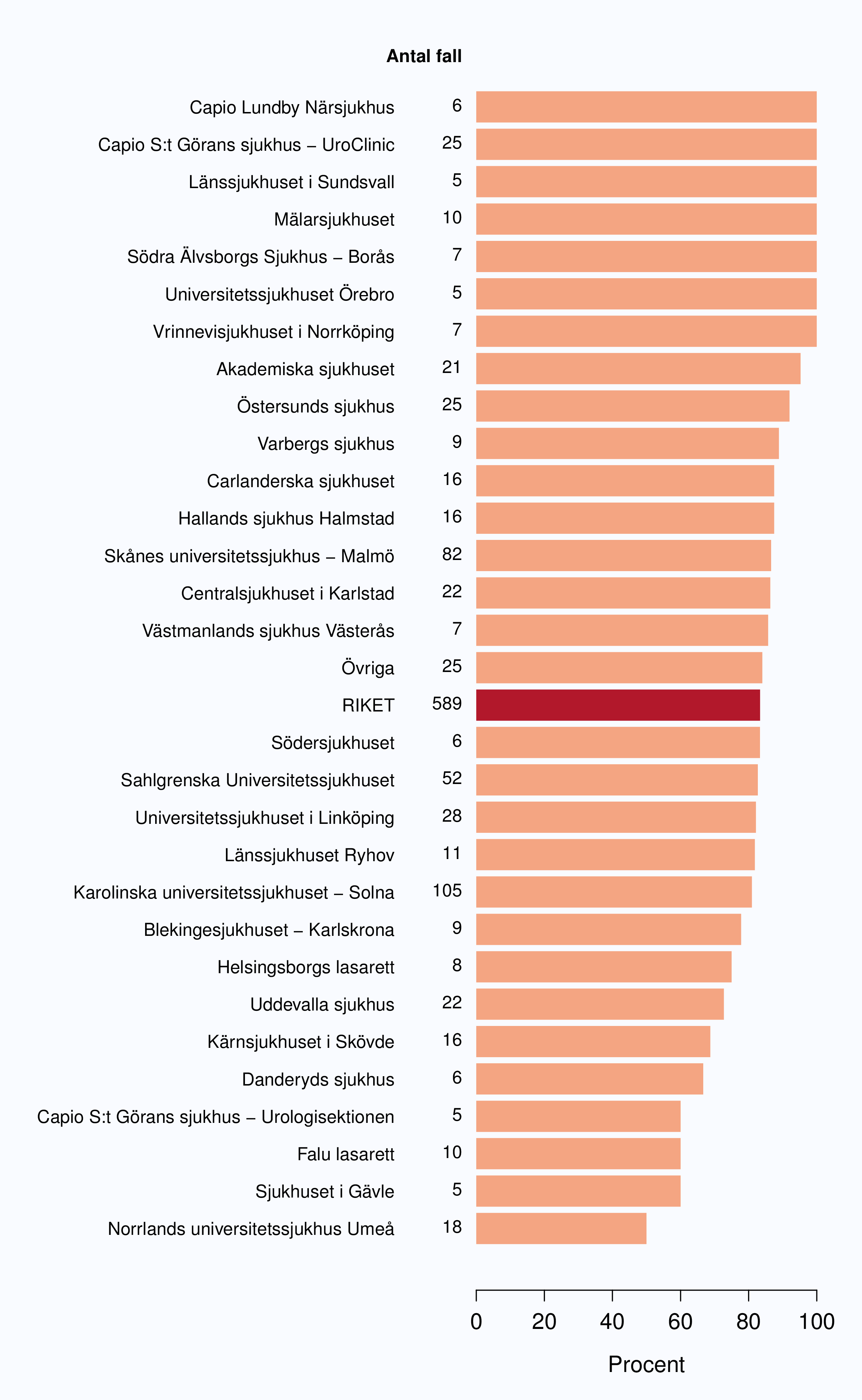
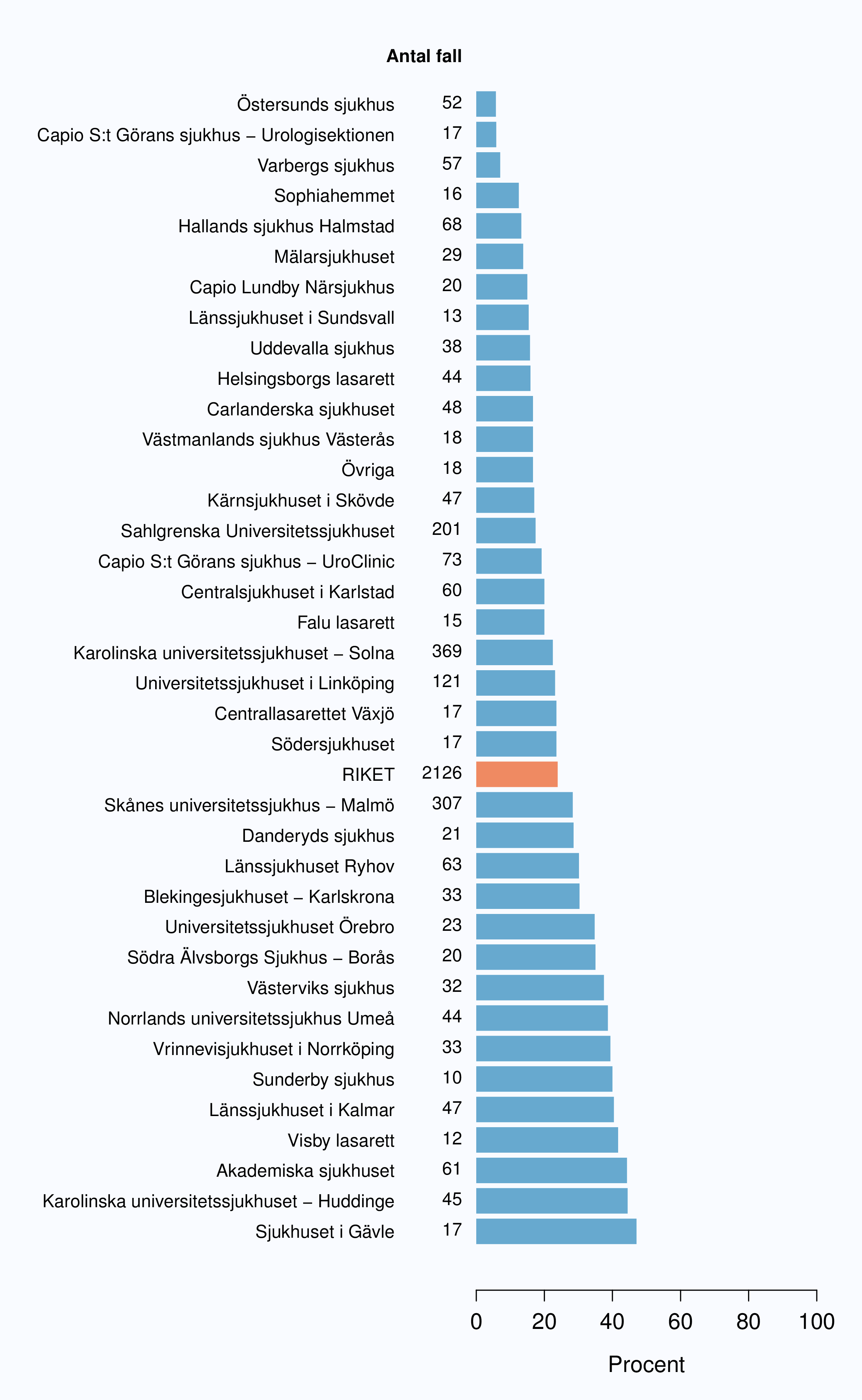
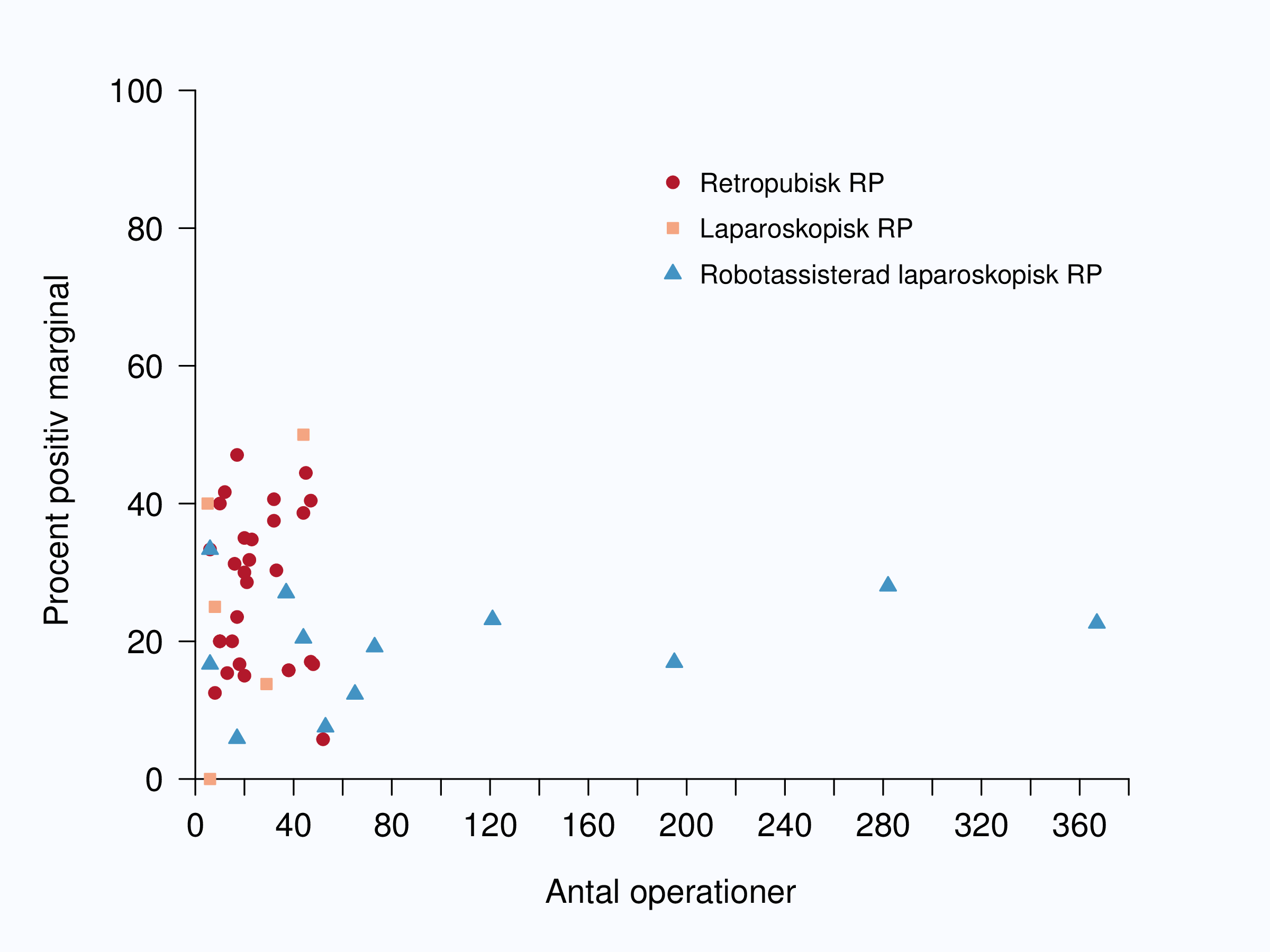
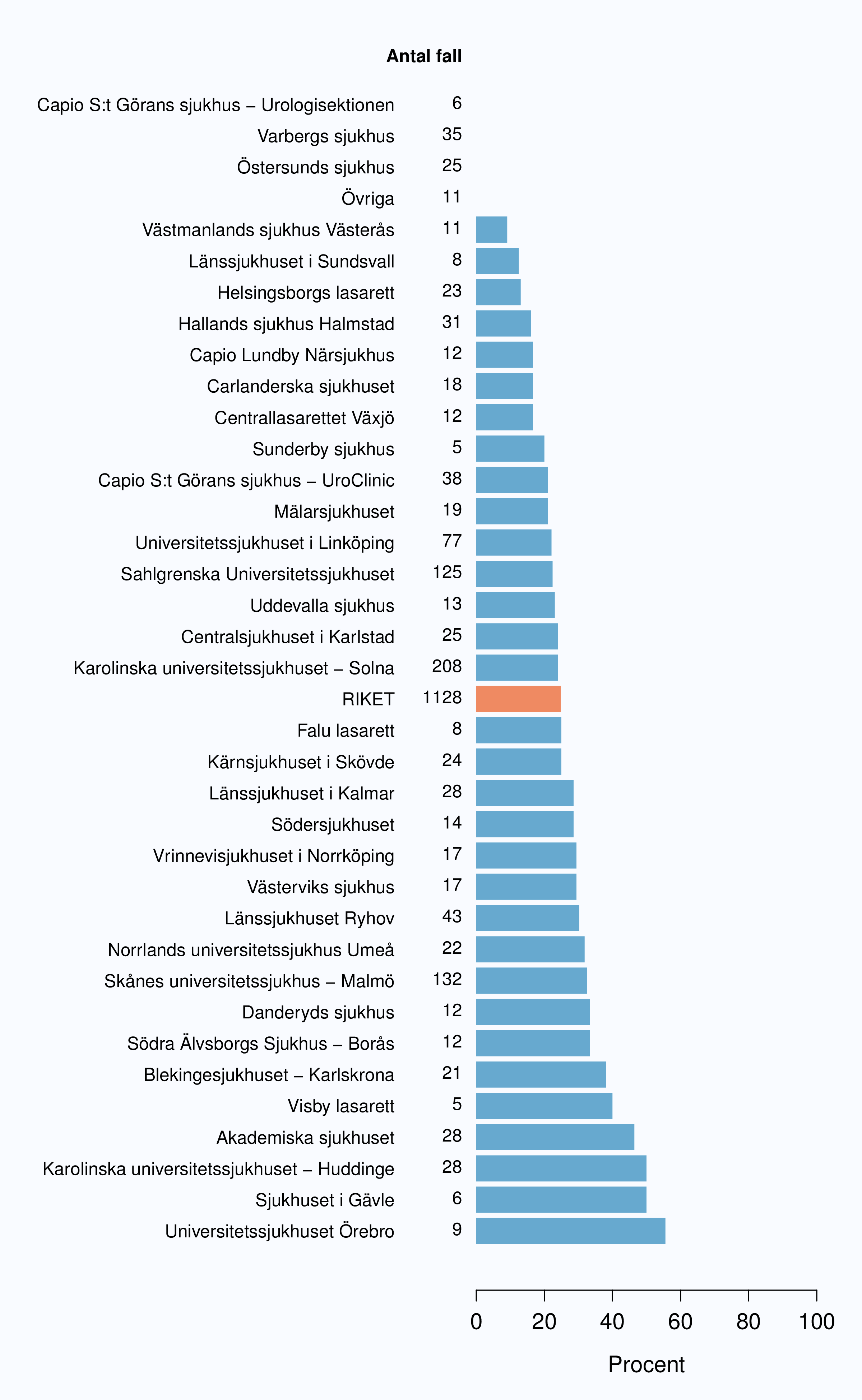
Andelen av opererade män med positiv marginal var i stort oförändrad mellan 2009 och 2012 (Tabell
14). Andel operationer med osäker uppgift om marginalstatus eller ingen uppgift om marginaler
varierade mellan 0-44 %, från 7 sjukhus saknades denna uppgift för mer än 20 % av operationerna
(Figur 52) Mellan sjukhusen i Sverige fanns en stor spridning av andelen positiva marginaler, från 6 till
drygt 50 % (Figur 53).
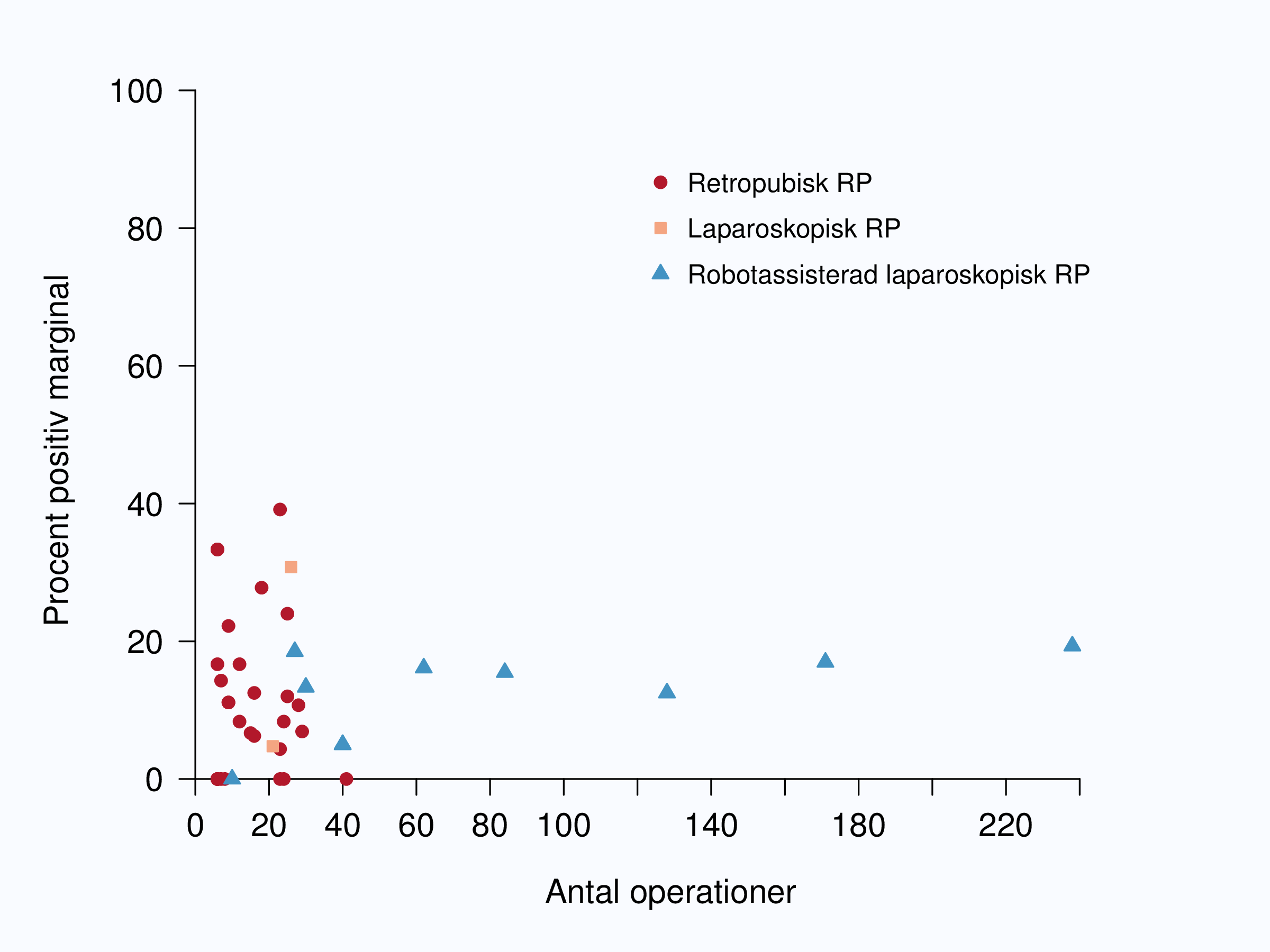
I ett försök att minska inflytandet av tumöregenskaper begränsade vi analysen i figur 54 till
pT2-tumörer och i figur 57 till intermediärrisktumörer. Fortfarande var spridningen mellan landets
sjukhus mycket stor. I figur 55 och 56 redovisas operationsvolym per sjukhus relaterat till
marginalstatus, dvs tumörradikalitet. För mindre enheter var spridningen stor medan för enheter som
utförde många ingrepp, vilket innebär sjukhus där RALP utfördes, var andelen positiva marginaler
ganska likartad kring 20 % och ingen lägre frekvens sågs bland de enheter som utförde allra flest
ingrepp. Det finns anledning att granska alla de faktorer ovan som påverkar bedömning av
marginalstatus för att få en komplett bild av vad av positiv marginalstatus påverkas av. På sikt kan
marginalstatus bli en viktig kvalitetsparameter och redan nu är dessa data viktiga för att stimulera till
analys av såväl operationsresultat som analys av andra faktorer förutom de rent operationstekniska
som kan påverka resultaten.
Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om marginalstatus ej är osäker eller saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) har grupperats till "Övriga".
Bland de män där uppgift om marginalstatus ej är osäker eller saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) har grupperats till "Övriga".
Bland de män där uppgift om marginalstatus ej är osäker eller saknas. Inom respektive typ av operation är sjukhus som bidrog med färre än 5 fall (Höglandssjukhuset, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) exkluderade.
Bland de män där uppgift om marginalstatus ej är osäker eller saknas. Inom respektive typ av operation är sjukhus som bidrog med färre än 5 fall (Höglandssjukhuset, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) exkluderade.
Bland de män där uppgift om marginalstatus ej är osäker eller saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Sophiahemmet, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus, Sjukhuset i Lidköping) har grupperats till "Övriga".
Adjuvant terapi efter prostatektomi
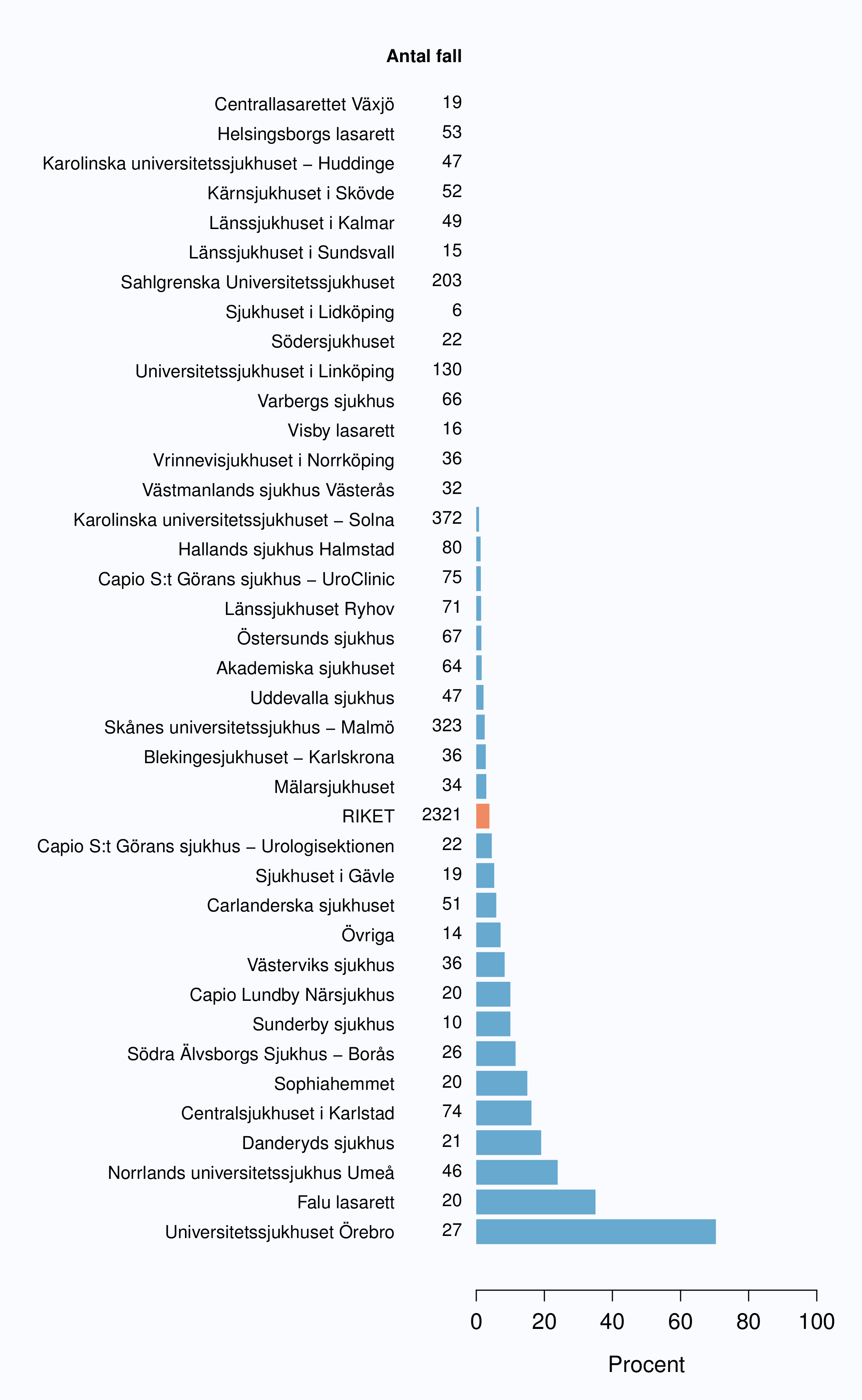
Radikal prostatektomi kan kompletteras med omedelbar tilläggsbehandling (adjuvant terapi), antingen
hormonbehandling eller strålbehandling. Den uppgiften saknades för 4 % av patienterna med en stor
variation mellan sjukhusen (Tabell 16 och Figur 58). För närvarande finns inte konsensus i Sverige om
adjuvant terapi vid positiv marginal och kapselgenombrott men det finns en internationell trend till en
ökad användning av strålbehandling postoperativt grundat på ett par nyligen publicerade
studier, men det sker i så fall till priset av överbehandling [11–13]. På de flesta enheter i
Sverige väntar man på PSA-relaps innan postoperativ strålbehandling startas. Däremot
råder det konsensus om att om strålbehandling ges vid PSA-återfall skall den ges redan vid
låga PSA-värden, och de nivåerna har successivt sjunkit under 2000-talet till 0.1-0.2 μg/L.
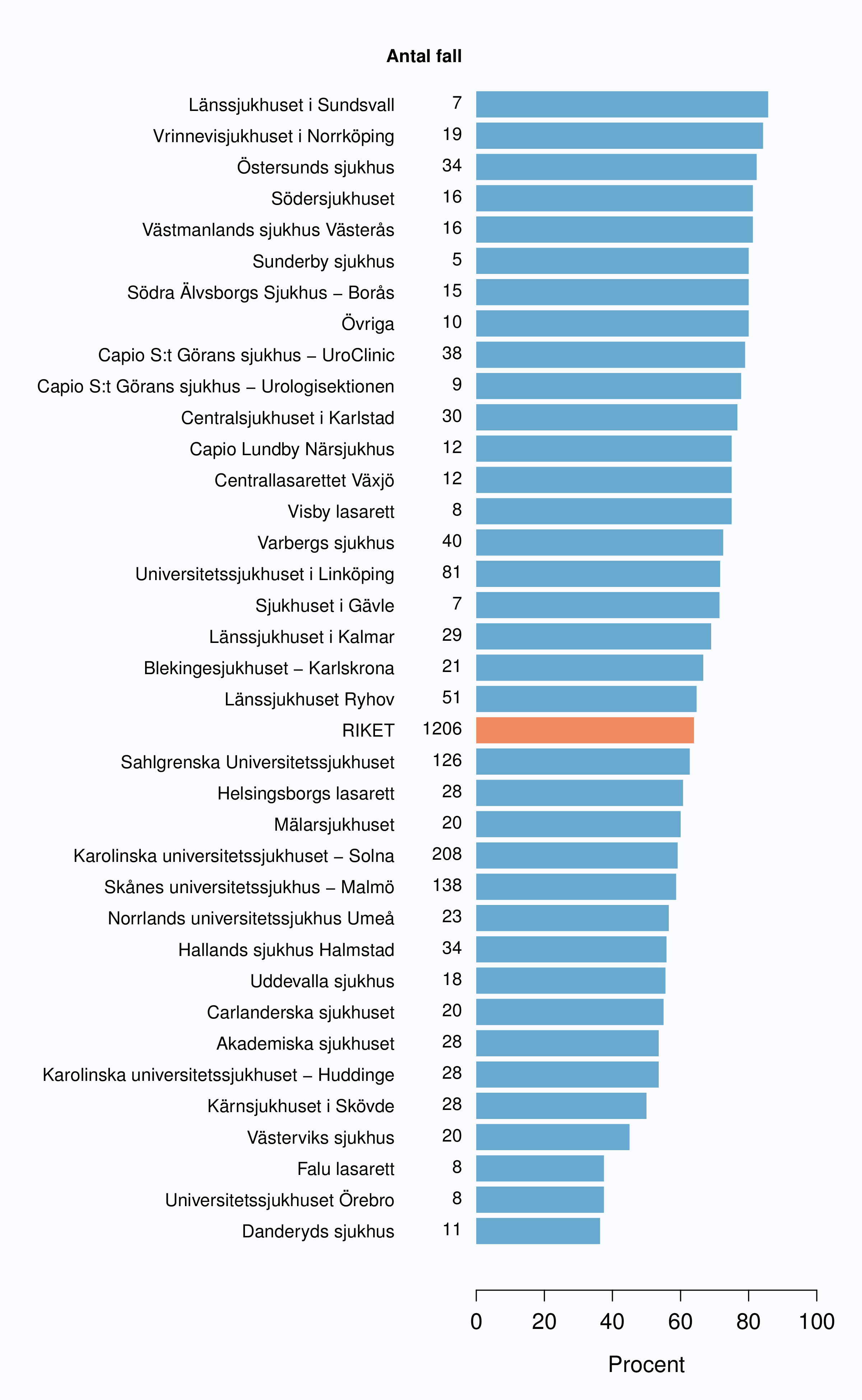
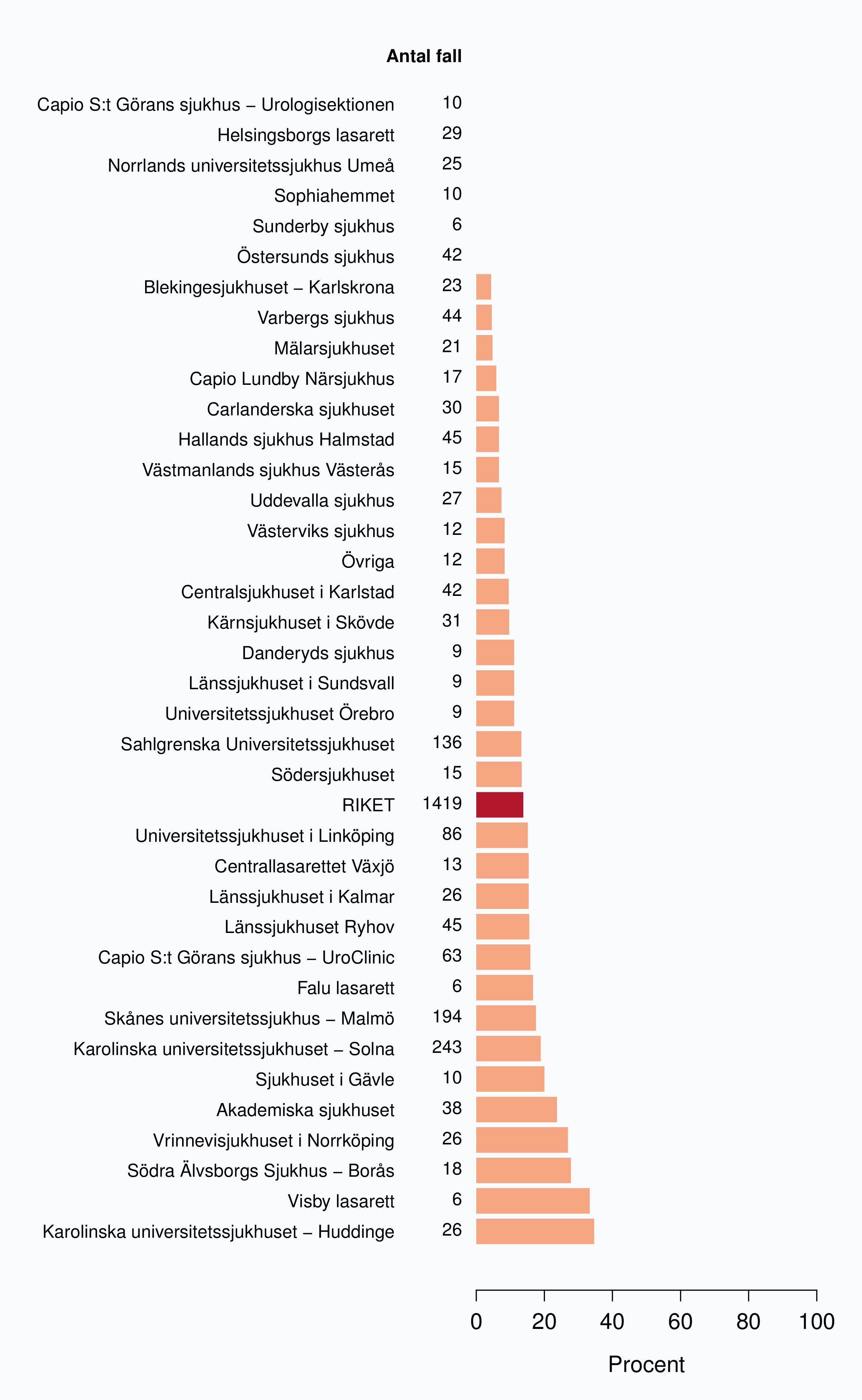
Det stora flertalet patienter fick inte någon adjuvant behandling 2009-2012, men andelen varierade
mellan sjukhusen. Vid ett sjukhus fick 43 % av opererade män strålbehandling postoperativt
(Tabell 16). Den stora spridningen i användandet av adjuvant strålbehandling ses även då
analysen begränsas till opererade patienter med pT3-tumörer och/eller positiv marginal (Figur
58).
| |
Ingen adjuvant terapi |
Hormonterapi |
RT |
Uppgift saknas |
Totalt |
| Behandlingsår | |||||
| 2009 | 2090 (83) | 39 (2) | 150 (6) | 241 (10) | 2520 |
| 2010 | 2209 (85) | 30 (1) | 122 (5) | 235 (9) | 2596 |
| 2011 | 2246 (87) | 45 (2) | 119 (5) | 169 (7) | 2579 |
| 2012 | 2113 (91) | 23 (1) | 95 (4) | 90 (4) | 2321 |
8 män med övriga kombinationer har grupperats in i "Uppgift saknas".
| |
Ingen adjuvant terapi |
Hormonterapi |
RT |
Uppgift saknas |
Totalt |
| Stockholm-Gotland | |||||
| Capio S:t Görans sjukhus - UroClinic | 73 (97) | 1 (1) | 0 (0) | 1 (1) | 75 |
| Capio S:t Görans sjukhus - Urologisektionen | 21 (95) | 0 (0) | 0 (0) | 1 (5) | 22 |
| Danderyds sjukhus | 15 (71) | 0 (0) | 2 (10) | 4 (19) | 21 |
| Karolinska universitetssjukhuset - Huddinge | 44 (94) | 2 (4) | 1 (2) | 0 (0) | 47 |
| Karolinska universitetssjukhuset - Solna | 365 (98) | 1 (0) | 3 (1) | 3 (1) | 372 |
| Sophiahemmet | 16 (80) | 0 (0) | 1 (5) | 3 (15) | 20 |
| Södersjukhuset | 22 (100) | 0 (0) | 0 (0) | 0 (0) | 22 |
| Visby lasarett | 12 (75) | 3 (19) | 1 (6) | 0 (0) | 16 |
| Uppsala-Örebro | |||||
| Akademiska sjukhuset | 61 (95) | 1 (2) | 1 (2) | 1 (2) | 64 |
| Centralsjukhuset i Karlstad | 60 (81) | 0 (0) | 2 (3) | 12 (16) | 74 |
| Falu lasarett | 11 (55) | 0 (0) | 2 (10) | 7 (35) | 20 |
| Mälarsjukhuset | 31 (91) | 0 (0) | 2 (6) | 1 (3) | 34 |
| Sjukhuset i Gävle | 14 (74) | 1 (5) | 3 (16) | 1 (5) | 19 |
| Universitetssjukhuset Örebro | 8 (30) | 0 (0) | 0 (0) | 19 (70) | 27 |
| Västmanlands sjukhus Västerås | 30 (94) | 1 (3) | 1 (3) | 0 (0) | 32 |
| Sydöstra | |||||
| Länssjukhuset i Kalmar | 27 (55) | 1 (2) | 21 (43) | 0 (0) | 49 |
| Länssjukhuset Ryhov | 68 (96) | 1 (1) | 1 (1) | 1 (1) | 71 |
| Universitetssjukhuset i Linköping | 127 (98) | 0 (0) | 3 (2) | 0 (0) | 130 |
| Vrinnevisjukhuset i Norrköping | 28 (78) | 1 (3) | 7 (19) | 0 (0) | 36 |
| Västerviks sjukhus | 25 (69) | 0 (0) | 8 (22) | 3 (8) | 36 |
| Övriga | 6 (86) | 0 (0) | 0 (0) | 1 (14) | 7 |
| Södra | |||||
| Blekingesjukhuset - Karlskrona | 33 (92) | 1 (3) | 1 (3) | 1 (3) | 36 |
| Centrallasarettet Växjö | 18 (95) | 0 (0) | 1 (5) | 0 (0) | 19 |
| Hallands sjukhus Halmstad | 75 (94) | 0 (0) | 4 (5) | 1 (1) | 80 |
| Helsingsborgs lasarett | 47 (89) | 2 (4) | 4 (8) | 0 (0) | 53 |
| Skånes universitetssjukhus - Malmö | 294 (91) | 5 (2) | 16 (5) | 8 (2) | 323 |
| Övriga | 1 (100) | 0 (0) | 0 (0) | 0 (0) | 1 |
| Västra | |||||
| Capio Lundby Närsjukhus | 18 (90) | 0 (0) | 0 (0) | 2 (10) | 20 |
| Carlanderska sjukhuset | 48 (94) | 0 (0) | 0 (0) | 3 (6) | 51 |
| Kärnsjukhuset i Skövde | 52 (100) | 0 (0) | 0 (0) | 0 (0) | 52 |
| Sahlgrenska Universitetssjukhuset | 198 (98) | 1 (0) | 4 (2) | 0 (0) | 203 |
| Sjukhuset i Lidköping | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 6 |
| Södra Älvsborgs Sjukhus - Borås | 23 (88) | 0 (0) | 0 (0) | 3 (12) | 26 |
| Uddevalla sjukhus | 45 (96) | 0 (0) | 1 (2) | 1 (2) | 47 |
| Varbergs sjukhus | 64 (97) | 1 (2) | 1 (2) | 0 (0) | 66 |
| Övriga | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 6 |
| Norra | |||||
| Länssjukhuset i Sundsvall | 14 (93) | 0 (0) | 1 (7) | 0 (0) | 15 |
| Norrlands universitetssjukhus Umeå | 33 (72) | 0 (0) | 2 (4) | 11 (24) | 46 |
| Sunderby sjukhus | 8 (80) | 0 (0) | 1 (10) | 1 (10) | 10 |
| Östersunds sjukhus | 66 (99) | 0 (0) | 0 (0) | 1 (1) | 67 |
| RIKET | |||||
| Totalt | 2113 (91) | 23 (1) | 95 (4) | 90 (4) | 2321 |
Sjukhus som till tabellen bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Sjukhus som till figuren bidrog med färre än 5 fall (Höglandssjukhuset, Oskarshamns sjukhus, Värnamo sjukhus, Simrishamns sjukhus, Alingsås lasarett, Kungälvs sjukhus) har grupperats till "Övriga".
Bland de män där uppgift om adjuvant terapi ej saknas. Sjukhus som till figuren bidrog med färre än 5 fall (Sophiahemmet, Universitetssjukhuset Örebro, Oskarshamns sjukhus, Värnamo sjukhus, Capio Lundby Närsjukhus, Kungälvs sjukhus, Sjukhuset i Lidköping, Länssjukhuset i Sundsvall, Sunderby sjukhus) har grupperats till "Övriga".
De senaste decenniernas forskning har visat att strålbehandling i botande syfte mot prostatacancer
kräver att dosen ökas 10-15 % jämfört med traditionell behandling. Det har blivit möjligt med modern
strålbehandlingsteknik. Under de senaste åren har en metod introducerats där man inför den yttre
strålbehandlingen placerar tre guldmarkörer i prostata med hjälp av ultraljudsundersökning. Detta
bidrar till att öka strålbehandlingens precision och har snabbt blivit rutin vid högdos strålbehandling
(Figur 65). I Sverige ges strålbehandling med flera olika tekniker. Den vanligaste tekniken är extern,
dvs. yttre strålbehandling, som kan ges med olika dagsdoser under 5-8 veckor. Tabell 21 och 22 visar
exempel på olika behandlingsscheman som ger en jämförbar biologisk behandlingseffekt
och hur de fördelas mellan de olika riskgrupperna. En annan metod att öka dosen är att
kombinera yttre och inre strålbehandling, brachyterapi. Den inre strålbehandlinen ges då med
s.k. högintensiv dosstrålning (HDR) som ger en koncentrerad strålning. Behandlingen ges
med patienten i ryggbedövning och oftast vid två tillfällen. Lågintensiv dosstrålning, LDR
brachyterapi (behandling med radioaktiva frön) ges på liknande sätt som HDR brachyterapi.
Behandlingen ges vid ett enda tillfälle då cirka 80 frön placeras i prostata. Tekniken lämpar sig
för behandling av prostatacancer av låg- eller intermediärrisk med begränsad utbredning.
Sedan 1998 ökade antalet män som strålbehandlats primärt från 491 män 1998 till 1660 män 2009.
En nedgång i antal strålbehandlade män ses 2012 för tredje året i följd. Mellan 2004 och
2012 minskade antalet män som fick brachyterapi med seeds från 300 till 87 (Tabell 17).
Vid åtta kliniker användes i princip enbart extern strålterapi 2012, vid fyra kliniker används metoden
med lågintensiv strålning i form av seeds samt även övriga modaliteter. Vid övriga kliniker ges extern
och kombinationen extern och HDR (Tabell 20).
| |
Extern |
Brachy |
Extern + brachy |
Totalt |
| Diagnosår | ||||
| 1998 | 329 (67) | 78 (16) | 84 (17) | 491 |
| 1999 | 394 (60) | 151 (23) | 110 (17) | 655 |
| 2000 | 469 (61) | 174 (23) | 121 (16) | 764 |
| 2001 | 497 (57) | 161 (18) | 219 (25) | 877 |
| 2002 | 524 (57) | 143 (16) | 247 (27) | 914 |
| 2003 | 561 (54) | 195 (19) | 285 (27) | 1041 |
| 2004 | 700 (55) | 300 (24) | 262 (21) | 1262 |
| 2005 | 649 (55) | 254 (22) | 272 (23) | 1175 |
| 2006 | 584 (57) | 229 (22) | 205 (20) | 1018 |
| 2007 | 680 (65) | 117 (11) | 256 (24) | 1053 |
| 2008 | 767 (64) | 108 (9) | 319 (27) | 1194 |
| 2009 | 1124 (68) | 141 (8) | 395 (24) | 1660 |
| 2010 | 1138 (71) | 92 (6) | 370 (23) | 1600 |
| 2011 | 992 (70) | 97 (7) | 327 (23) | 1416 |
| 2012 | 963 (76) | 87 (7) | 217 (17) | 1267 |
137 män är exkluderade ur tabellen då det saknades uppgift om typ av strålterapi.
| |
RT utförd |
RT ej utförd |
Strål- blankett saknas |
Totalt |
| Diagnosår | ||||
| 2009 | 1643 (96) | 23 (1) | 48 (3) | 1714 |
| 2010 | 1580 (95) | 21 (1) | 62 (4) | 1663 |
| 2011 | 1376 (93) | 30 (2) | 79 (5) | 1485 |
| 2012 | 1114 (82) | 12 (1) | 237 (17) | 1363 |
| |
Extern |
Brachy |
Extern + brachy |
Totalt |
| Stockholm-Gotland | ||||
| Karolinska universitetssjukhuset - Solna/Södersjukhuset | 110 (41) | 13 (5) | 144 (54) | 267 |
| Uppsala-Örebro | ||||
| Akademiska sjukhuset | 49 (42) | 0 (0) | 68 (58) | 117 |
| Centralsjukhuset i Karlstad | 45 (98) | 0 (0) | 1 (2) | 46 |
| Mälarsjukhuset | 47 (100) | 0 (0) | 0 (0) | 47 |
| Sjukhuset i Gävle | 37 (97) | 0 (0) | 1 (3) | 38 |
| Universitetssjukhuset Örebro | 47 (81) | 10 (17) | 1 (2) | 58 |
| Västmanlands sjukhus Västerås | 55 (98) | 0 (0) | 1 (2) | 56 |
| Sydöstra | ||||
| Länssjukhuset i Kalmar | 35 (97) | 0 (0) | 1 (3) | 36 |
| Länssjukhuset Ryhov | 27 (61) | 17 (39) | 0 (0) | 44 |
| Universitetssjukhuset i Linköping | 29 (59) | 0 (0) | 20 (41) | 49 |
| Södra | ||||
| Centrallasarettet Växjö | 62 (98) | 0 (0) | 1 (2) | 63 |
| Skånes universitetssjukhus - Lund | 88 (56) | 59 (38) | 10 (6) | 157 |
| Västra | ||||
| Sahlgrenska Universitetssjukhuset | 24 (51) | 0 (0) | 23 (49) | 47 |
| Södra Älvsborgs Sjukhus - Borås | 22 (67) | 0 (0) | 11 (33) | 33 |
| Norra | ||||
| Länssjukhuset i Sundsvall | 81 (100) | 0 (0) | 0 (0) | 81 |
| Norrlands universitetssjukhus Umeå | 190 (100) | 0 (0) | 0 (0) | 190 |
| RIKET | ||||
| Totalt | 948 (71) | 99 (7) | 282 (21) | 1329 |
I årets NPCR-rapport har vi ett mått som indikator för kvalitén på omhändertagandet av män som
behandlats med kurativ extern strålterapi. Måttet är andelen män med lågrisktumörer som fick
GnRH-analoger inför strålbehandling (dvs. neoadjuvant hormonbehandling), vilket är ett ”inte göra
mått”. Det finns ingen evidens för att neoadjuvant hormonbehandling är av godo för denna grupp, och
Socialstyrelsens Riktlinjer anger att neoadjuvant hormonbehandling endast ska användas på
högriskpatienter med en förväntad överlevnad mer än 10 år. Under de senaste åren har dessutom flera
studier, bland annat från NPCR, påvisat en måttligt ökad risk för hjärtsjukdom, tromboembolism och
osteoporosrelaterade frakturer vid hormonbehandling med GnRH-agonister, och risken förefaller öka
redan kort tid efter insatt behandling [14–17]. Andelen män med lågrisktumör som fick
hormonbehandling före strålbehandling var 18 % år 2011-2012 i riket och i sju landsting fick
mer än 20 % av alla män med lågrisktumör GnRH-analoger inför strålterapi (Figur 60).
Vid högrisk prostatacancer erhöll cirka 80 % av patienterna neoadjuvant hormonterapi inför
strålbehandling med GNRH-analoger eller TAB i riket som helhet. Regionalt varierade andelen män
som erhöll behandling mellan 0 och 100 % (Figur 66).
Bland de män där uppgift om neoadjuvant hormonbehandling ej saknas.
| |
2.0 Gy |
2.5 Gy |
3.0 Gy |
6.1 Gy |
Totalt |
| Stockholm-Gotland | |||||
| Karolinska universitetssjukhuset - Solna/Södersjukhuset | 1 (2) | 40 (95) | 1 (2) | 0 (0) | 42 |
| Uppsala-Örebro | |||||
| Akademiska sjukhuset | 19 (100) | 0 (0) | 0 (0) | 0 (0) | 19 |
| Centralsjukhuset i Karlstad | 16 (80) | 0 (0) | 0 (0) | 4 (20) | 20 |
| Mälarsjukhuset | 2 (8) | 23 (92) | 0 (0) | 0 (0) | 25 |
| Sjukhuset i Gävle | 15 (100) | 0 (0) | 0 (0) | 0 (0) | 15 |
| Universitetssjukhuset Örebro | 2 (29) | 0 (0) | 5 (71) | 0 (0) | 7 |
| Västmanlands sjukhus Västerås | 31 (100) | 0 (0) | 0 (0) | 0 (0) | 31 |
| Sydöstra | |||||
| Länssjukhuset i Kalmar | 15 (79) | 0 (0) | 0 (0) | 4 (21) | 19 |
| Länssjukhuset Ryhov | 18 (86) | 0 (0) | 0 (0) | 3 (14) | 21 |
| Universitetssjukhuset i Linköping | 13 (100) | 0 (0) | 0 (0) | 0 (0) | 13 |
| Södra | |||||
| Centrallasarettet Växjö | 30 (97) | 0 (0) | 0 (0) | 1 (3) | 31 |
| Skånes universitetssjukhus - Lund | 35 (80) | 0 (0) | 0 (0) | 9 (20) | 44 |
| Västra | |||||
| Sahlgrenska Universitetssjukhuset | 5 (56) | 0 (0) | 3 (33) | 1 (11) | 9 |
| Södra Älvsborgs Sjukhus - Borås | 4 (67) | 0 (0) | 2 (33) | 0 (0) | 6 |
| Norra | |||||
| Länssjukhuset i Sundsvall | 45 (88) | 0 (0) | 0 (0) | 6 (12) | 51 |
| Norrlands universitetssjukhus Umeå | 88 (80) | 0 (0) | 0 (0) | 22 (20) | 110 |
| RIKET | |||||
| Totalt | 339 (73) | 63 (14) | 11 (2) | 50 (11) | 463 |
3 män är exkluderade ur tabellen då övrig fraktionsdos var angiven eller uppgift saknades.
| |
2.0 Gy |
2.5 Gy |
3.0 Gy |
6.1 Gy |
Totalt |
| Stockholm-Gotland | |||||
| Karolinska universitetssjukhuset - Solna/Södersjukhuset | 3 (6) | 44 (90) | 2 (4) | 0 (0) | 49 |
| Uppsala-Örebro | |||||
| Akademiska sjukhuset | 20 (100) | 0 (0) | 0 (0) | 0 (0) | 20 |
| Centralsjukhuset i Karlstad | 22 (100) | 0 (0) | 0 (0) | 0 (0) | 22 |
| Mälarsjukhuset | 2 (12) | 13 (81) | 1 (6) | 0 (0) | 16 |
| Sjukhuset i Gävle | 18 (100) | 0 (0) | 0 (0) | 0 (0) | 18 |
| Universitetssjukhuset Örebro | 5 (17) | 0 (0) | 24 (80) | 1 (3) | 30 |
| Västmanlands sjukhus Västerås | 23 (100) | 0 (0) | 0 (0) | 0 (0) | 23 |
| Sydöstra | |||||
| Länssjukhuset i Kalmar | 12 (86) | 0 (0) | 0 (0) | 2 (14) | 14 |
| Länssjukhuset Ryhov | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 6 |
| Universitetssjukhuset i Linköping | 12 (100) | 0 (0) | 0 (0) | 0 (0) | 12 |
| Södra | |||||
| Centrallasarettet Växjö | 27 (100) | 0 (0) | 0 (0) | 0 (0) | 27 |
| Skånes universitetssjukhus - Lund | 31 (91) | 0 (0) | 0 (0) | 3 (9) | 34 |
| Västra | |||||
| Sahlgrenska Universitetssjukhuset | 8 (100) | 0 (0) | 0 (0) | 0 (0) | 8 |
| Södra Älvsborgs Sjukhus - Borås | 11 (79) | 0 (0) | 3 (21) | 0 (0) | 14 |
| Norra | |||||
| Länssjukhuset i Sundsvall | 21 (95) | 0 (0) | 0 (0) | 1 (5) | 22 |
| Norrlands universitetssjukhus Umeå | 61 (97) | 0 (0) | 0 (0) | 2 (3) | 63 |
| RIKET | |||||
| Totalt | 282 (75) | 57 (15) | 30 (8) | 9 (2) | 378 |
1 män är exkluderade ur tabellen då övrig fraktionsdos var angiven eller uppgift saknades.
Bland de män där uppgift om inklusion av lymfkörtlar ej saknas.
Bland de män där uppgift om adjuvant hormonbehandling ej saknas.
| |
Adjuvant |
Salvage |
Totalt |
| Stockholm-Gotland | |||
| Karolinska universitetssjukhuset - Solna/Södersjukhuset | 1 (2) | 54 (98) | 55 |
| Uppsala-Örebro | |||
| Akademiska sjukhuset | 1 (6) | 15 (94) | 16 |
| Centralsjukhuset i Karlstad | 4 (31) | 9 (69) | 13 |
| Mälarsjukhuset | 1 (6) | 17 (94) | 18 |
| Sjukhuset i Gävle | 2 (20) | 8 (80) | 10 |
| Sydöstra | |||
| Länssjukhuset i Kalmar | 31 (82) | 7 (18) | 38 |
| Länssjukhuset Ryhov | 1 (11) | 8 (89) | 9 |
| Universitetssjukhuset i Linköping | 20 (43) | 27 (57) | 47 |
| Södra | |||
| Centrallasarettet Växjö | 1 (17) | 5 (83) | 6 |
| Skånes universitetssjukhus - Lund | 12 (21) | 44 (79) | 56 |
| Skånes universitetssjukhus - Malmö | 1 (100) | 0 (0) | 1 |
| Västra | |||
| Sahlgrenska Universitetssjukhuset | 0 (0) | 24 (100) | 24 |
| Södra Älvsborgs Sjukhus - Borås | 1 (3) | 29 (97) | 30 |
| Norra | |||
| Länssjukhuset i Sundsvall | 4 (27) | 11 (73) | 15 |
| Norrlands universitetssjukhus Umeå | 1 (3) | 29 (97) | 30 |
| RIKET | |||
| Totalt | 81 (22) | 287 (78) | 368 |
I Socialstyrelsens reviderade Riktlinjer anges att kurativ strålterapi med neoadjuvant
GnRH-behandling följt av adjuvant antiandrogenbehandling ad modum SPCG-7 har högst
prioritet vid behandling av män med lokalt avancerad prostatacancer som är i övrigt friska
och har en lång förväntad överlevnad eftersom det finns starkast evidens för effekten av
denna behandling. SPCG-7-studien visade att män med lokalt avancerade tumörer som
behandlades med strålterapi och hormonbehandling hade hälften så stor risk att dö av
prostatacancer upp till tio år efter diagnos i jämförelse med män som behandlades med
enbart hormonbehandling och den studien har fått starkt genomslag på hur man ser på
behandlingen av lokalt avancerad prostatacancer [8]. Om den förväntade överlevnaden är mindre
än fem år förespråkar Riktlinjerna hormonell behandling vid symptomgivande progress.
Vi kartlade därför behandlingen av män med lokalt avancerad prostatacancer definierad
som kliniskt lokalstadium T3 eller PSA 20-50 μg/L, ej N1 ej M1, dvs. utan metastaser i
lymfkörtlar eller skelett i ålderskategorierna 75 år eller yngre och 76-80 år. Behandlingen av
dessa män varierade stort mellan landstingen (Figur 67-70). Totalt i riket behandlades
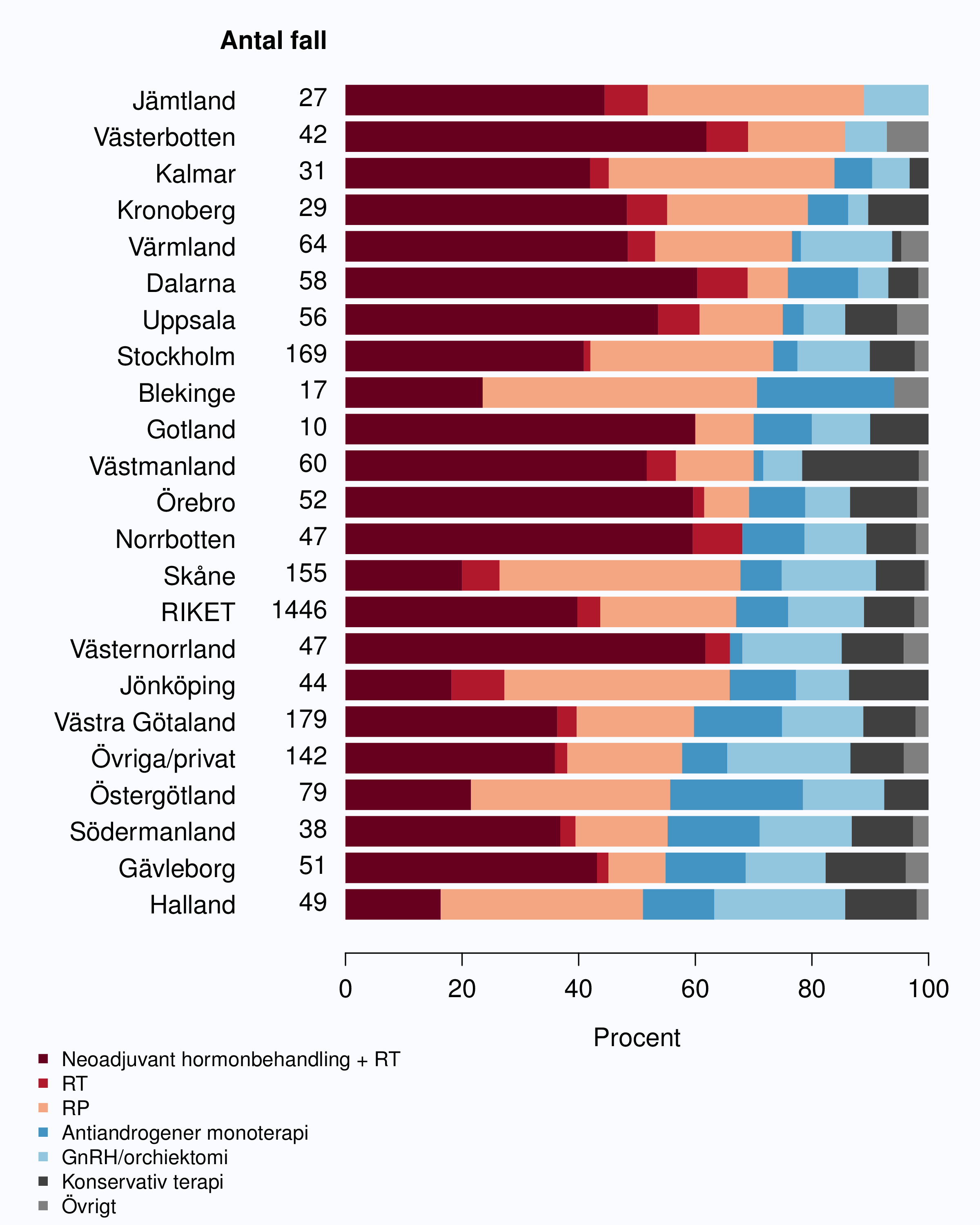
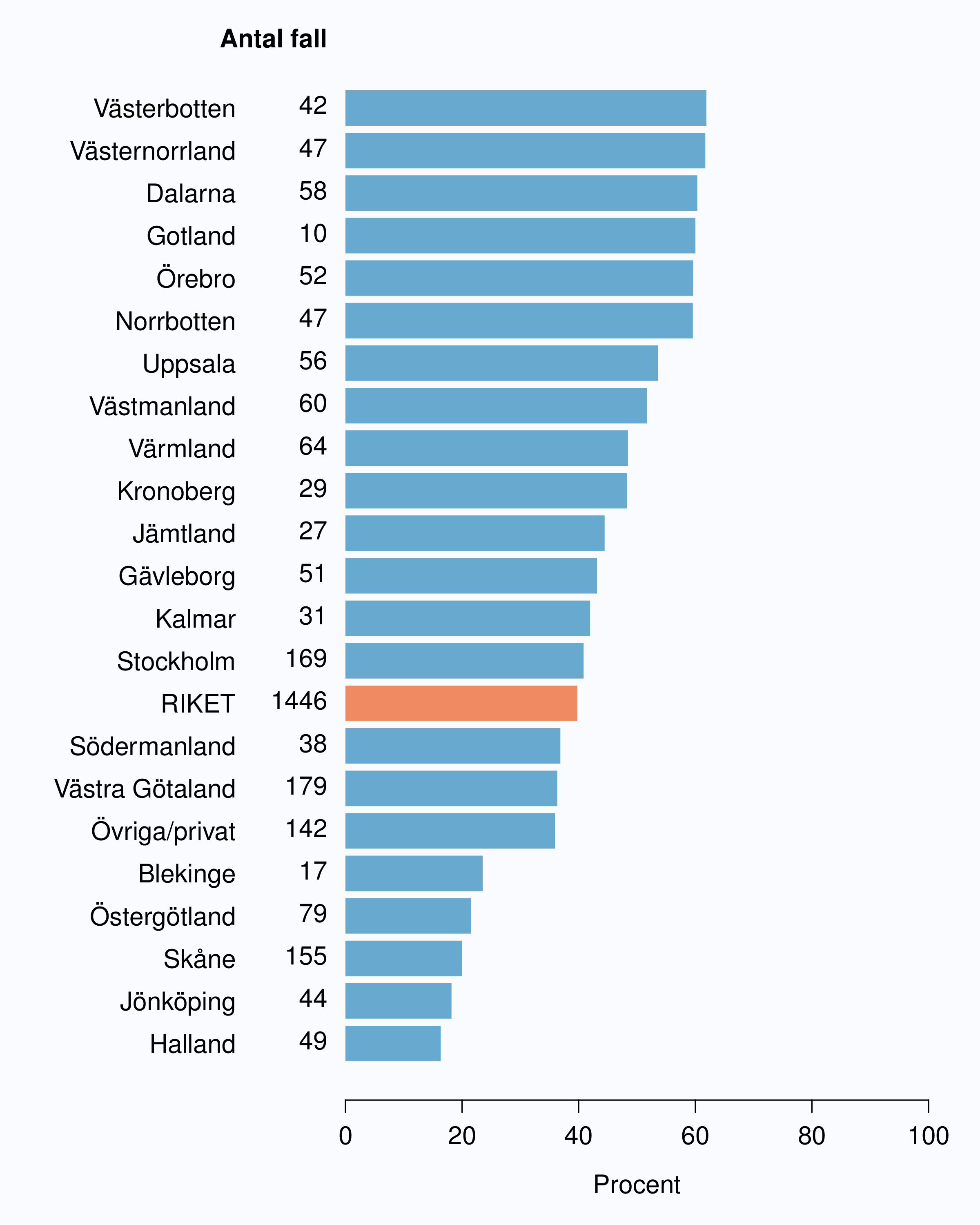
ungefär 67 % av männen 75 år eller yngre med kurativ behandling, och 40 % fick neoadjuvant
hormonbehandling följt av strålbehandling (Figur 67), andelen varierade mellan 16-62 % i landets
landsting (Figur 68). I denna grupp av män är det rimligt att en större andel ska erhålla
kurativ behandling och NPCR föreslår målnivån 90 % behandlade med kurativ terapi.
Starkast evidens för effekt vid lokalt avancerade tumörer är kombination av strålterapi och
hormonbehandling ad modum SPCG-7 [8]. Hormonbehandlingen som ges adjuvant, dvs. efter
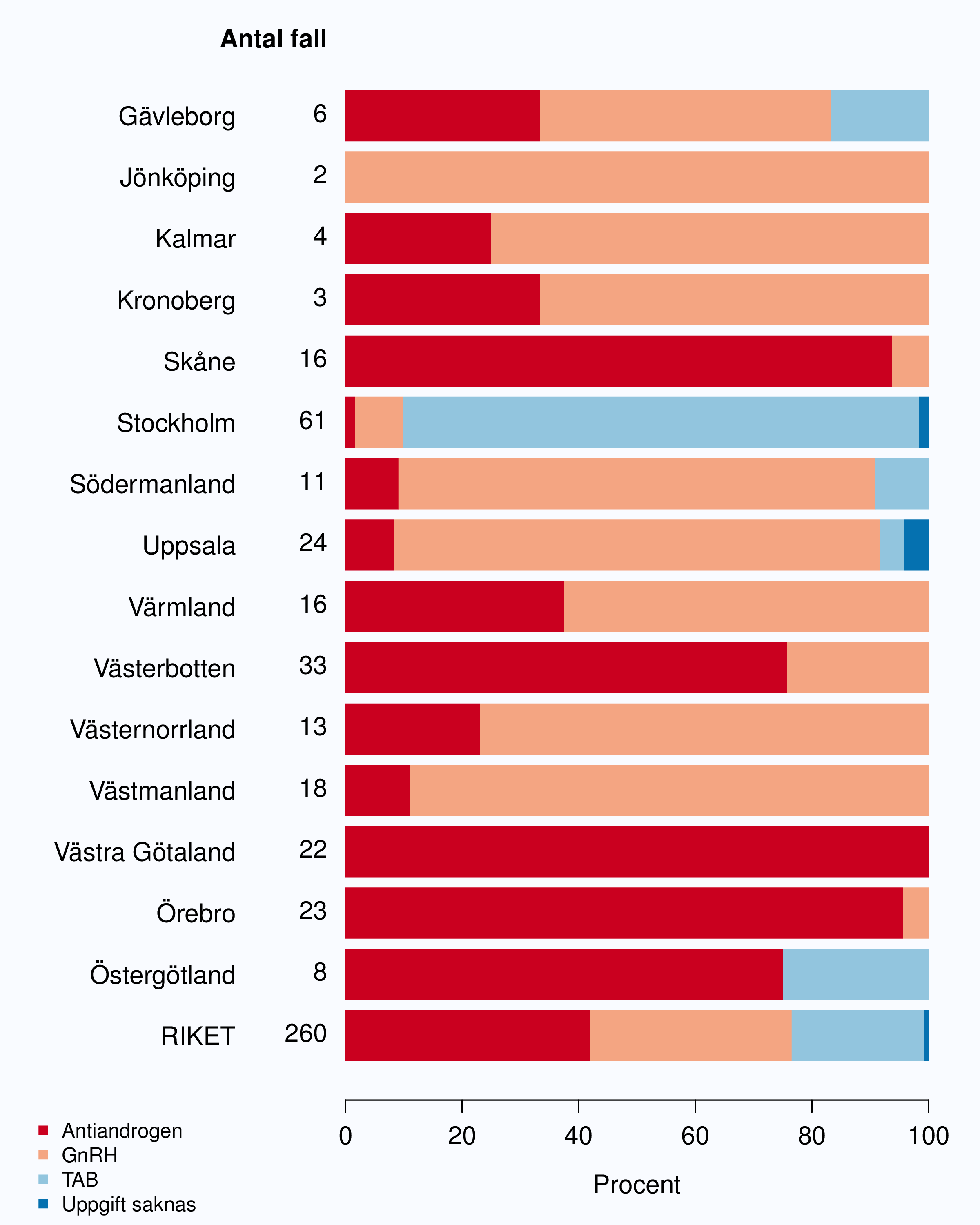
strålbehandlingen, varierar kraftigt över landet där riksgenomsnittet är 40 % antiandrogen och
den resterande delen övervägande erhåller GnRH analoger, men TAB förekommer också.
Även för längden på denna behandling finns det en stor variation i riket (Figur 63 och 64).
Bland män 76-80 år med lokalt avancerad cancer var kurativ behandling ovanlig, de flesta erhöll
hormonbehandling (Figur 53). Knappt 10 % av män 76-80 år med lokalt avancerad tumör erhöll
neoadjuvant hormonbehandling och strålterapi (Figur 70). I de flesta landsting var den vanligaste
behandlingsstrategin primär GnRH-analogbehandling. Dessa data tyder på en underanvändning av
antiandrogener och en överanvändning av GnRH-analoger vid val av hormonbehandling.
Enligt nuvarande riktlinjer rekommenderas symtomstyrd behandling vid lokalt avancerad tumör bland
män med en förväntad överlevnad som är mindre än fem år, men en 76 årig man har idag en förväntad
överlevnad på 10 år och en 80-årig man 8 år [18], så i denna grupp finns också en underbehandling.
Bland dessa män över 75 års ålder med lokalt avancerad tumör finns en grupp som har en förväntad
överlevnad som klart överstiger fem år, och för dem finns det indikation för kurativ terapi. På
grund av det svagare evidensläget för effekt av terapi och med hänsyn till samsjuklighet och
patientens önskemål är det dock inte möjligt att idag sätta en målnivå för denna grupp.
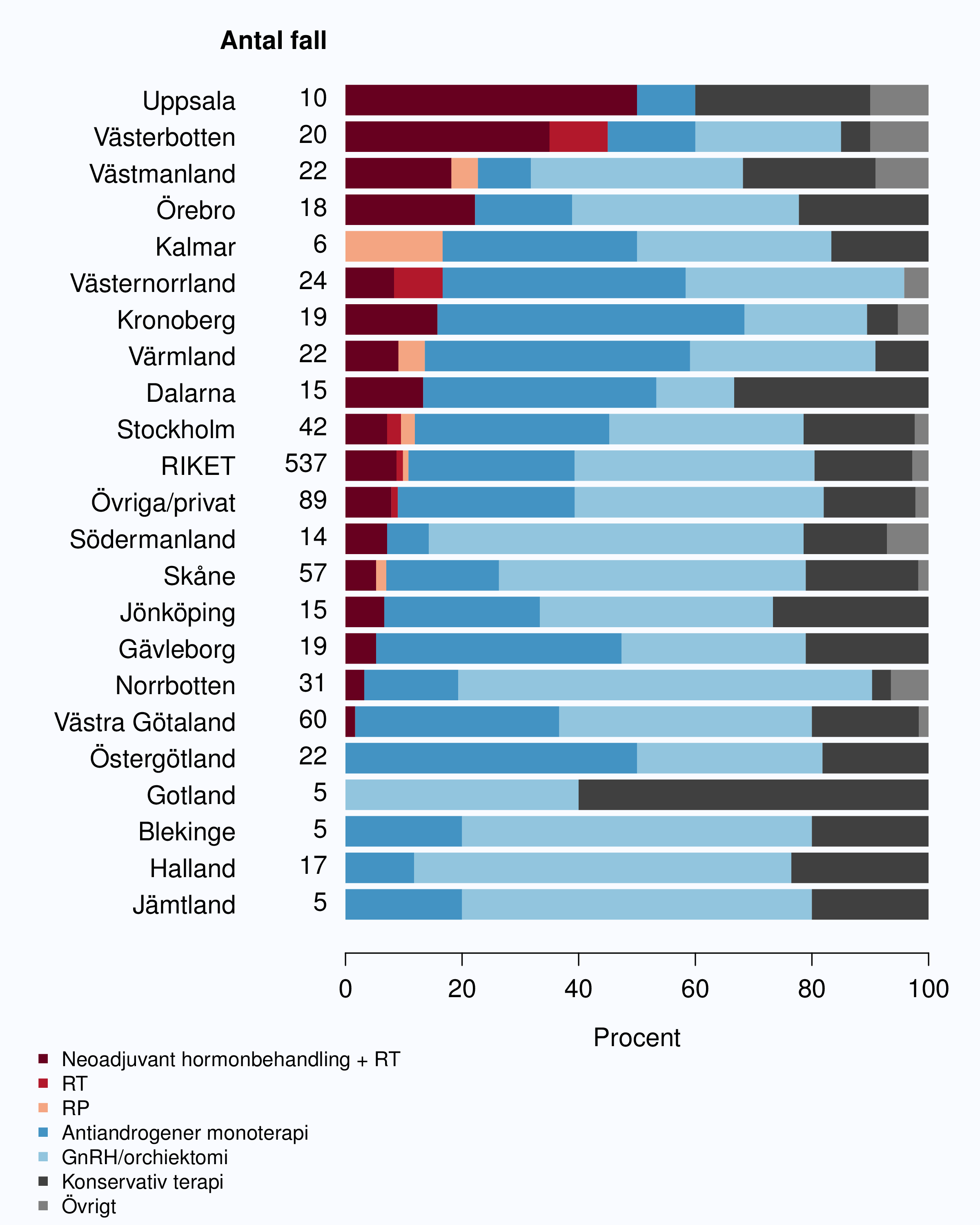
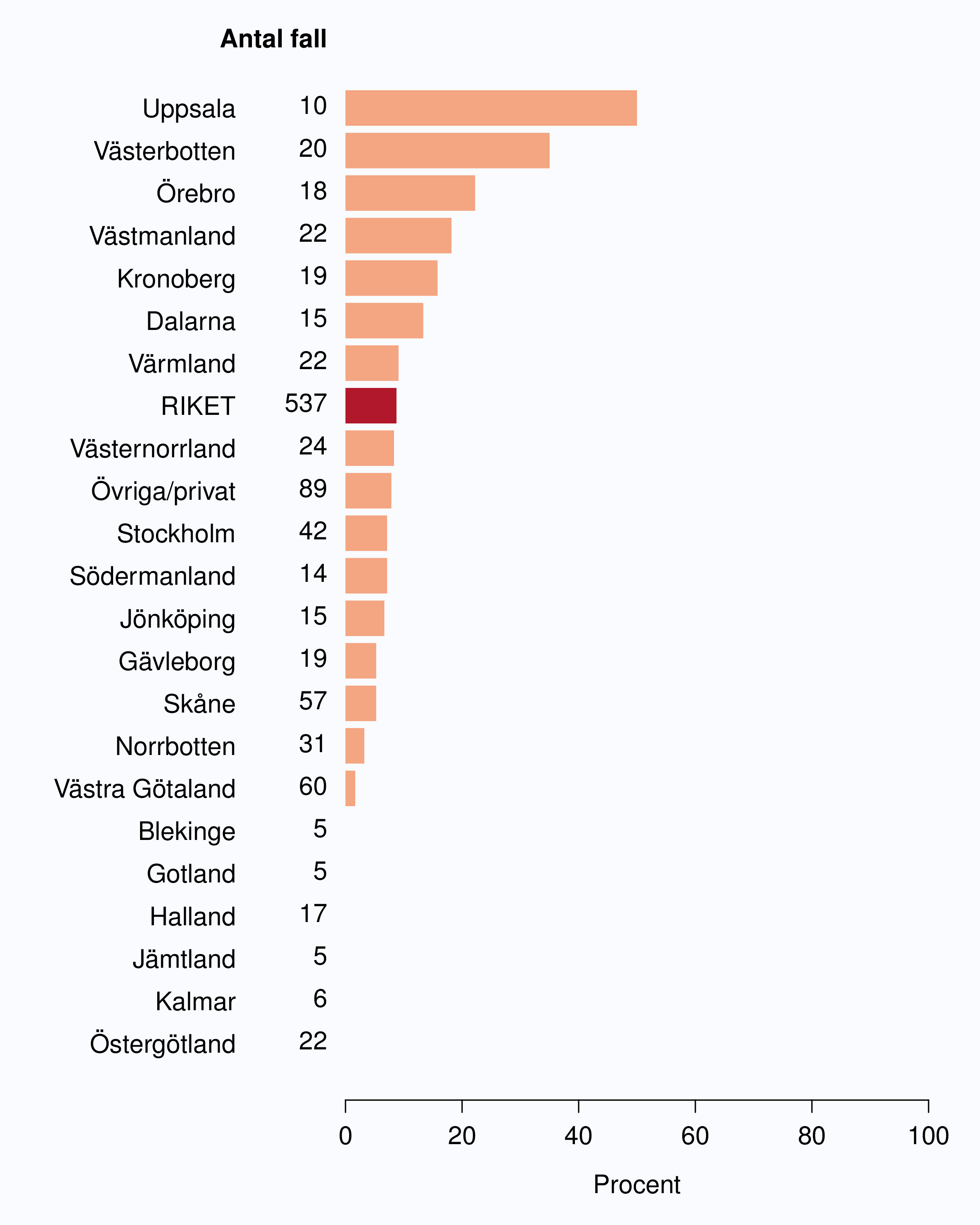
Speglande den internationella trenden med strålbehandling mot lymfkörtelstationer i adjuvant syfte
hos lokalt avancerade tumörer ser vi att den behandlingen används på ungefär hälften av landets
kliniker. År 2012 gavs sådan behandling i 10 landsting (Figur 61).
Bland de män där uppgift om behandling ej saknas.
Bland de män där uppgift om behandling ej saknas.
Bland de män där uppgift om behandling ej saknas.
Bland de män där uppgift om behandling ej saknas.
Bland de män där uppgift om behandling ej saknas.
Bland de män där uppgift om behandling ej saknas.
För att kartlägga förekomsten av biverkningar används enkäter i NPCR för att erhålla
patientupplevda biverkningar relaterade till behandling, ”patient reported outcome measures;
PROM”. Patienter som opereras eller strålas får före behandling besvara en enkät som
jämförs med enkätsvar ett och fem år efter behandling. Spridningen och införandet av
detta kräver en stor arbetsinsats, bl.a. för att hitta rutiner för distribution av enkäterna på
varje sjukhus. Vi har kommit en bit på väg och kan för tredje året nu redovisa data för
PROM. Enkäten innehåller 44 frågor om urinvägsbesvär, tarmbesvär, sexualfunktion samt en
allmän del. Enkäten har reviderats inför 2013 och vi pilotar för närvarande en web-enkät.
Vi kan i år redovisa data från enkät före behandling och ett år efter behandling från 2 824 män som
opererats eller strålbehandlats. Medianålder för retropubiskt opererade var 64 år och för män som
opererades med robotassisterad laparoskopisk teknik 63 år och män som strålades 67 år (Tabell
24).
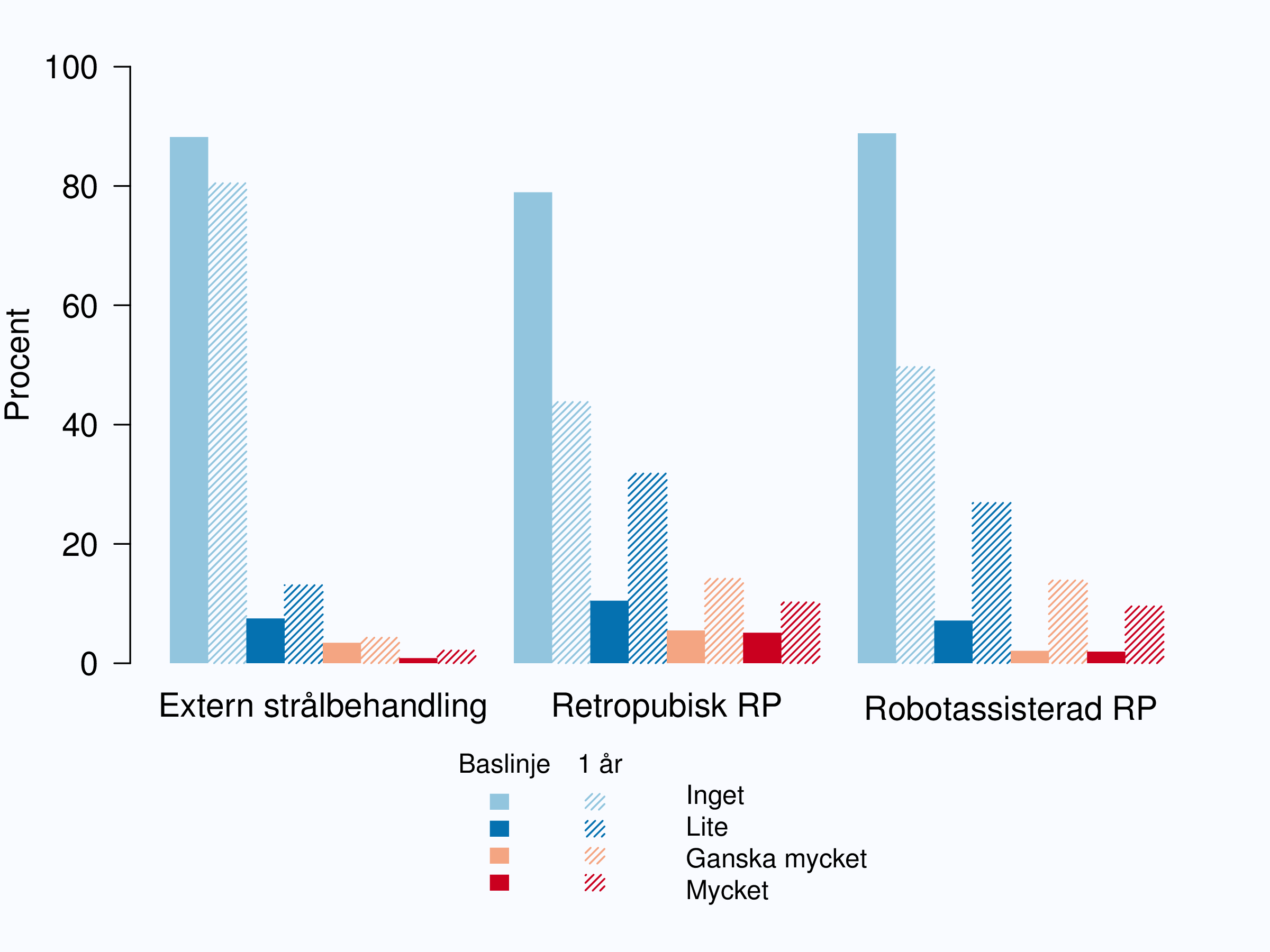
I figur 73 redovisas ansträngningsinkontinens bland män som genomgått extern strålbehandling, retropubisk, öppen operation och robotassisterad laparoskopisk operation. Andelen män med ansträngningsinkontinens ökade mer efter operation än efter strålning. Mest uttalad var ökningen av ”lite” inkontinens efter retropubisk operation, men ”ganska mycket” och mycket inkontinens ökade också klart efter både retropubisk och robotassisterad operation.
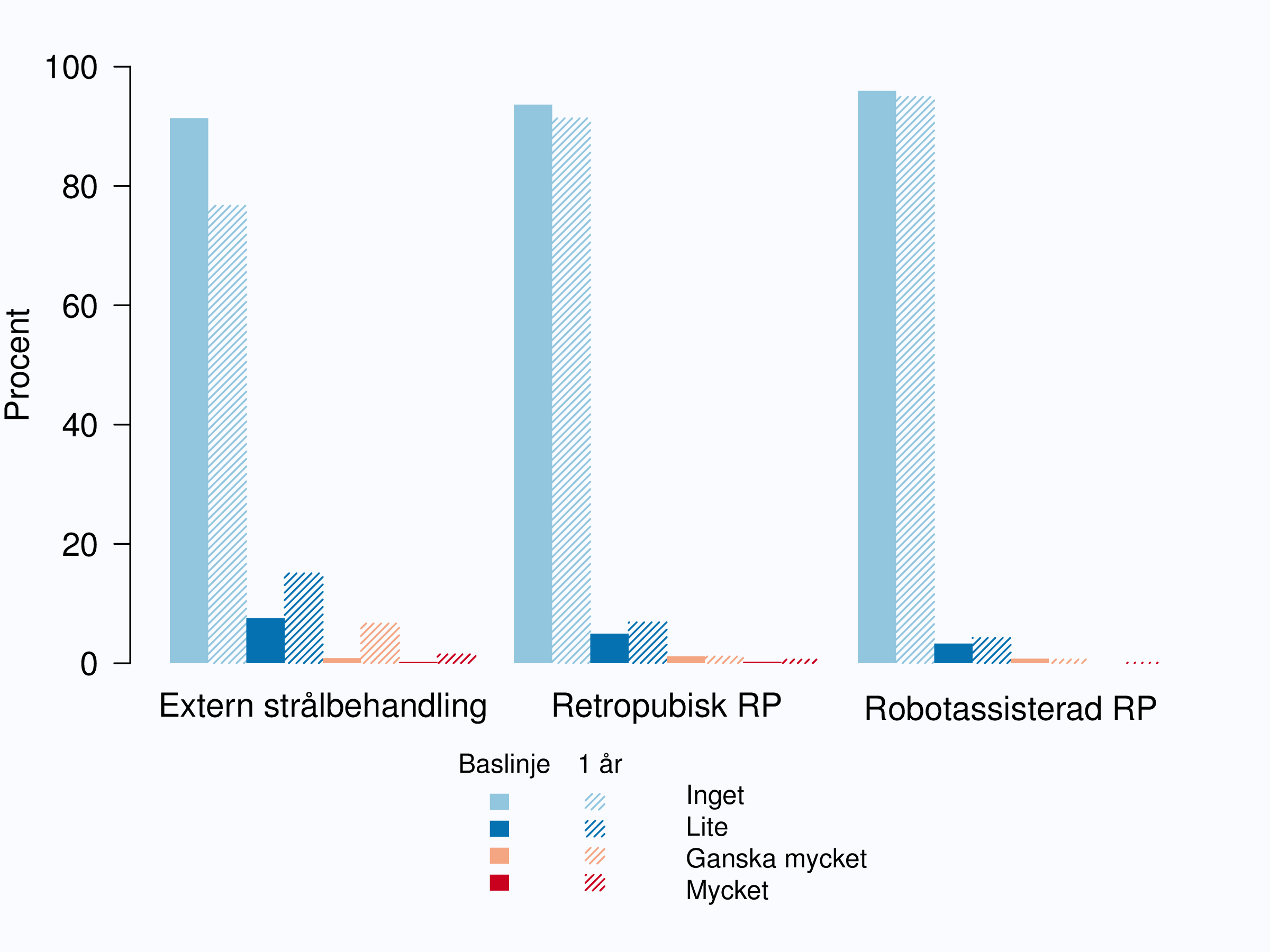
Besvär från tarmen drabbar framför allt män som behandlats med extern strålbehandling. I den grupp av män som behandlats med strålbehandling hade 8 % ”lite” tarmsymtom innan behandling och ett år efter behandling hade 15 % ”lite” besvär, 7 % ”ganska mycket” och 2 % hade ”mycket” tarmbesvär (Figur 74).
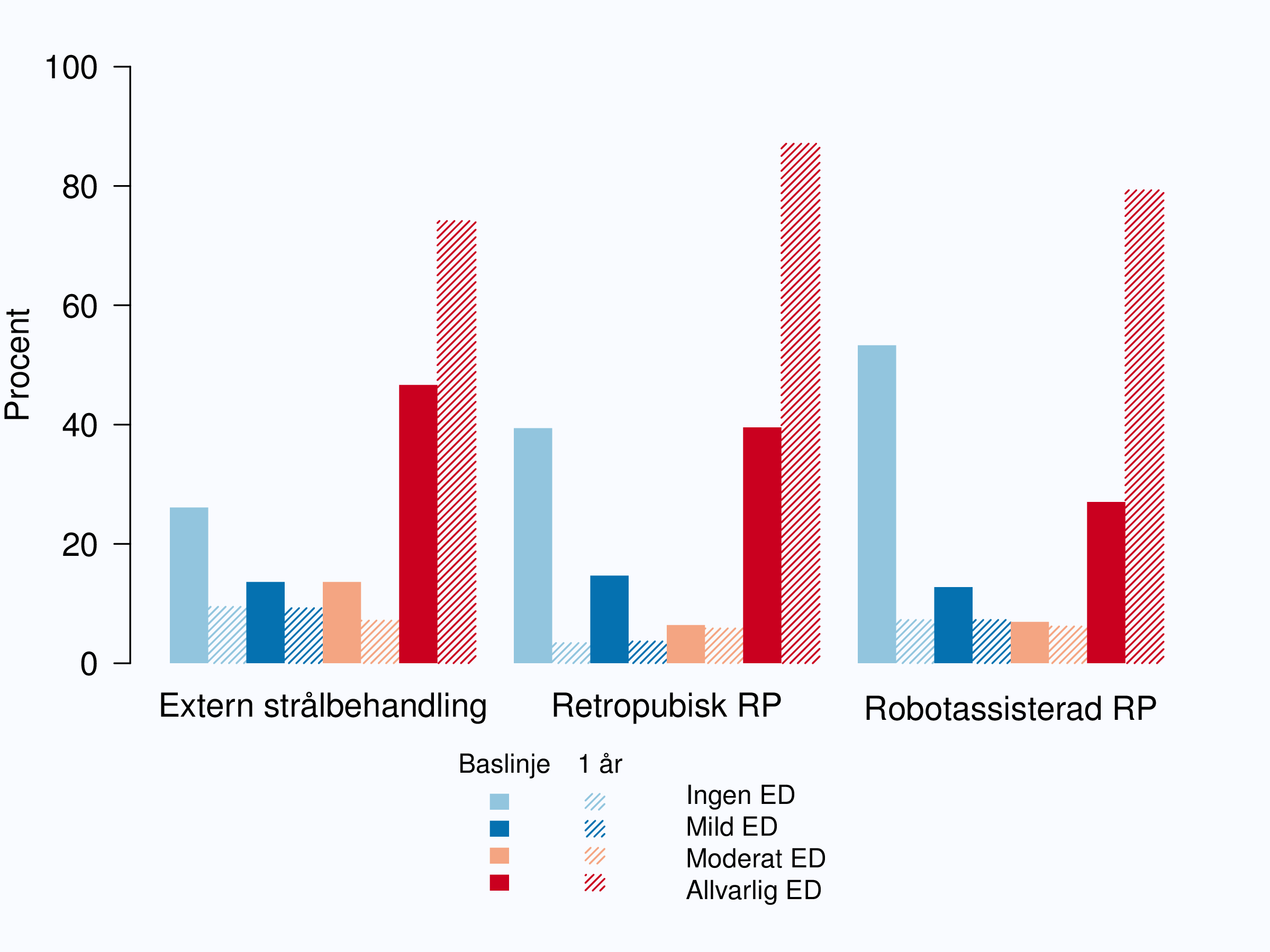
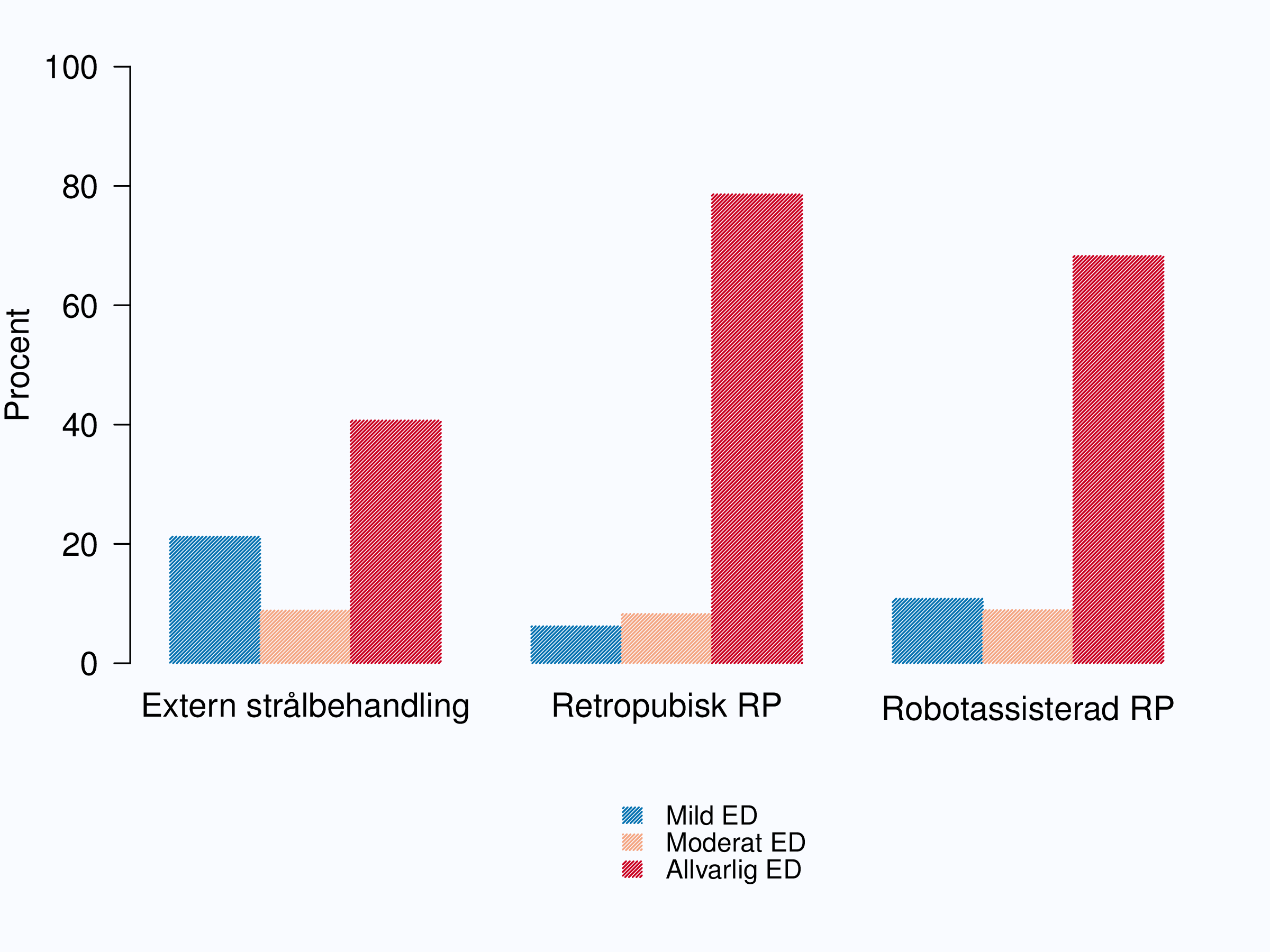
Erektil dysfunktion (ED), dvs. oförmåga att få stånd, är illustrerad i figur 75. Det fanns en klar skillnad i frekvensen av ED före behandling, högst andel ”allvarlig” ED hade män som strålades följt av män som genomgått öppen operation. Efter behandlingen ökade andelen män med erektil dysfunktion kraftigt, ökningen var kraftigast efter operation och mer än 80 % av män som opererats öppet eller robotassisterat rapporterade allvarlig ED ett år efter operation.
PSA-nivån vid diagnos hos patienter med påvisade fjärrmetastaser (M1) har sjunkit från ett
medianvärde strax över 200 μg/L 1998 till 120 μg/L 2012 (Figur 77). Det visar att det skett en ”stage
migration” även inom kategorin fjärrmetastaserad sjukdom.
Tabell 25a-25b visar behandling av män med M1 eller PSA över 100 μg/L, totalt 941 män i landet
med diagnos under 2012. Den vanligaste behandlingen var GnRH-analog 72 %, bilateral
orchiektomi (kirurgisk kastration med bortopererande av testiklarna) 12 % och monoterapi med
antiandrogen 9 %. För 275 män utan påvisade metastaser, men med PSA över 100 μg/L, var
behandlingen GnRH-analog i 68 %, orchiektomi i 10 % och antiandrogener i 16 % (Tabell
26a-26b).
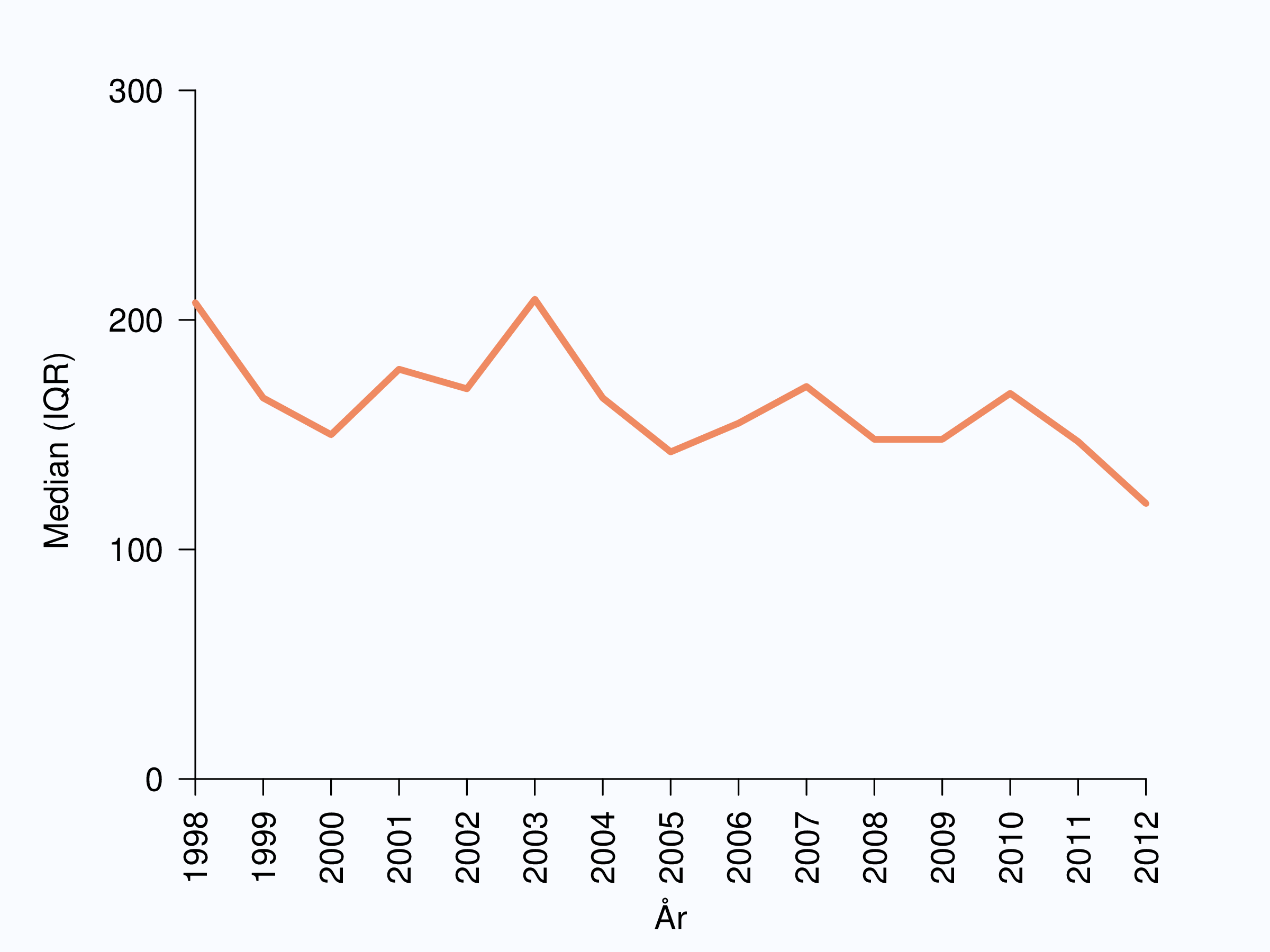
| |
Orchiektomi |
GnRH |
GnRH + AA kontinuerligt |
Endast AA |
Totalt |
| Stockholm-Gotland | |||||
| Capio S:t Görans sjukhus - Urologisektionen | 0 (0) | 9 (75) | 0 (0) | 3 (25) | 12 |
| Danderyds sjukhus | 5 (38) | 8 (62) | 0 (0) | 0 (0) | 13 |
| Karolinska universitetssjukhuset - Huddinge | 2 (8) | 22 (85) | 2 (8) | 0 (0) | 26 |
| Karolinska universitetssjukhuset - Solna | 3 (23) | 9 (69) | 1 (8) | 0 (0) | 13 |
| Löwet specialistmottagning | 0 (0) | 7 (78) | 0 (0) | 2 (22) | 9 |
| Norrtälje sjukhus | 0 (0) | 2 (33) | 2 (33) | 2 (33) | 6 |
| Södersjukhuset | 10 (30) | 16 (48) | 7 (21) | 0 (0) | 33 |
| Södertälje sjukhus | 1 (10) | 3 (30) | 5 (50) | 1 (10) | 10 |
| Visby lasarett | 0 (0) | 7 (100) | 0 (0) | 0 (0) | 7 |
| Privatläkare | 1 (4) | 23 (92) | 1 (4) | 0 (0) | 25 |
| Uppsala-Örebro | |||||
| Akademiska sjukhuset | 10 (29) | 18 (53) | 3 (9) | 3 (9) | 34 |
| Centralsjukhuset i Karlstad | 4 (10) | 33 (85) | 2 (5) | 0 (0) | 39 |
| Falu lasarett | 11 (38) | 15 (52) | 0 (0) | 3 (10) | 29 |
| Karlskoga lasarett | 0 (0) | 4 (100) | 0 (0) | 0 (0) | 4 |
| Kullbergska sjukhuset | 0 (0) | 2 (67) | 1 (33) | 0 (0) | 3 |
| Lasarettet i Enköping | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Lindesbergs lasarett | 4 (67) | 2 (33) | 0 (0) | 0 (0) | 6 |
| Ludvika lasarett | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Mora lasarett | 0 (0) | 6 (75) | 0 (0) | 2 (25) | 8 |
| Mälarsjukhuset | 0 (0) | 7 (58) | 3 (25) | 2 (17) | 12 |
| Nyköpings lasarett | 1 (7) | 6 (40) | 7 (47) | 1 (7) | 15 |
| Sjukhuset i Arvika | 0 (0) | 4 (80) | 0 (0) | 1 (20) | 5 |
| Sjukhuset i Gävle | 5 (28) | 11 (61) | 1 (6) | 1 (6) | 18 |
| Sjukhuset i Hudiksvall | 1 (5) | 19 (95) | 0 (0) | 0 (0) | 20 |
| Sjukhuset i Torsby | 0 (0) | 3 (100) | 0 (0) | 0 (0) | 3 |
| Universitetssjukhuset Örebro | 0 (0) | 19 (90) | 0 (0) | 2 (10) | 21 |
| Västmanlands sjukhus Västerås | 7 (21) | 22 (67) | 1 (3) | 3 (9) | 33 |
| Privatläkare | 0 (0) | 1 (25) | 0 (0) | 3 (75) | 4 |
| Sydöstra | |||||
| Höglandssjukhuset | 2 (10) | 12 (60) | 3 (15) | 3 (15) | 20 |
| Länssjukhuset i Kalmar | 0 (0) | 9 (69) | 2 (15) | 2 (15) | 13 |
| Länssjukhuset Ryhov | 0 (0) | 10 (71) | 2 (14) | 2 (14) | 14 |
| Oskarshamns sjukhus | 0 (0) | 4 (100) | 0 (0) | 0 (0) | 4 |
| Universitetssjukhuset i Linköping | 1 (3) | 22 (67) | 1 (3) | 9 (27) | 33 |
| Vrinnevisjukhuset i Norrköping | 2 (7) | 18 (67) | 4 (15) | 3 (11) | 27 |
| Värnamo sjukhus | 0 (0) | 4 (57) | 0 (0) | 3 (43) | 7 |
| Västerviks sjukhus | 0 (0) | 7 (100) | 0 (0) | 0 (0) | 7 |
| Privatläkare | 0 (0) | 2 (67) | 1 (33) | 0 (0) | 3 |
| |
Orchiektomi |
GnRH |
GnRH + AA kontinuerligt |
Endast AA |
Totalt |
| Södra | |||||
| Blekingesjukhuset - Karlshamn | 0 (0) | 5 (83) | 1 (17) | 0 (0) | 6 |
| Blekingesjukhuset - Karlskrona | 0 (0) | 11 (79) | 1 (7) | 2 (14) | 14 |
| Centrallasarettet Växjö | 1 (9) | 6 (55) | 1 (9) | 3 (27) | 11 |
| Centralsjukhuset Kristianstad | 0 (0) | 3 (100) | 0 (0) | 0 (0) | 3 |
| Hallands sjukhus Halmstad | 0 (0) | 10 (83) | 1 (8) | 1 (8) | 12 |
| Helsingsborgs lasarett | 2 (10) | 18 (86) | 0 (0) | 1 (5) | 21 |
| Lasarettet i Landskrona | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Lasarettet i Ystad | 0 (0) | 6 (75) | 0 (0) | 2 (25) | 8 |
| Lasarettet Trelleborg | 0 (0) | 3 (100) | 0 (0) | 0 (0) | 3 |
| Ljungby lasarett | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Simrishamns sjukhus | 0 (0) | 0 (0) | 1 (100) | 0 (0) | 1 |
| Skånes universitetssjukhus - Malmö | 3 (7) | 39 (91) | 0 (0) | 1 (2) | 43 |
| Ängelholms sjukhus | 0 (0) | 5 (56) | 0 (0) | 4 (44) | 9 |
| Privatläkare | 0 (0) | 7 (78) | 1 (11) | 1 (11) | 9 |
| Västra | |||||
| Alingsås lasarett | 0 (0) | 7 (100) | 0 (0) | 0 (0) | 7 |
| Hallands sjukhus Kungsbacka | 0 (0) | 6 (100) | 0 (0) | 0 (0) | 6 |
| Kungälvs sjukhus | 0 (0) | 7 (100) | 0 (0) | 0 (0) | 7 |
| Kärnsjukhuset i Skövde | 6 (46) | 7 (54) | 0 (0) | 0 (0) | 13 |
| Sahlgrenska Universitetssjukhuset | 0 (0) | 36 (88) | 3 (7) | 2 (5) | 41 |
| Sjukhuset i Falköping | 1 (20) | 4 (80) | 0 (0) | 0 (0) | 5 |
| Sjukhuset i Lidköping | 7 (78) | 2 (22) | 0 (0) | 0 (0) | 9 |
| Sjukhuset i Mariestad | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Specialistsjukvården Falkenberg | 0 (0) | 4 (100) | 0 (0) | 0 (0) | 4 |
| Södra Älvsborgs Sjukhus - Borås | 1 (33) | 2 (67) | 0 (0) | 0 (0) | 3 |
| Södra Älvsborgs Sjukhus - Skene | 0 (0) | 0 (0) | 5 (100) | 0 (0) | 5 |
| Uddevalla sjukhus | 1 (3) | 31 (79) | 0 (0) | 7 (18) | 39 |
| Varbergs sjukhus | 0 (0) | 8 (67) | 4 (33) | 0 (0) | 12 |
| Privatläkare | 0 (0) | 8 (89) | 0 (0) | 1 (11) | 9 |
| Norra | |||||
| Kalix sjukhus | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Lycksele lasarett | 1 (17) | 5 (83) | 0 (0) | 0 (0) | 6 |
| Länssjukhuset i Sundsvall | 2 (9) | 21 (91) | 0 (0) | 0 (0) | 23 |
| Norrlands universitetssjukhus Umeå | 7 (35) | 12 (60) | 0 (0) | 1 (5) | 20 |
| Piteå älvdals sjukhus | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Skellefteå lasarett | 2 (22) | 7 (78) | 0 (0) | 0 (0) | 9 |
| Sollefteå sjukhus | 5 (62) | 2 (25) | 1 (12) | 0 (0) | 8 |
| Sunderby sjukhus | 4 (33) | 7 (58) | 0 (0) | 1 (8) | 12 |
| Örnsköldsviks sjukhus | 1 (20) | 3 (60) | 1 (20) | 0 (0) | 5 |
| Östersunds sjukhus | 1 (8) | 10 (83) | 0 (0) | 1 (8) | 12 |
| RIKET | |||||
| Totalt | 115 (12) | 677 (72) | 69 (7) | 80 (9) | 941 |
4 fick övrig hormonterapi och är därför exkluderade ur tabellen.
| |
Orchiektomi |
GnRH |
GnRH + AA kontinuerligt |
Endast AA |
Totalt |
| Stockholm-Gotland | |||||
| Capio S:t Görans sjukhus - Urologisektionen | 0 (0) | 1 (33) | 0 (0) | 2 (67) | 3 |
| Danderyds sjukhus | 0 (0) | 5 (100) | 0 (0) | 0 (0) | 5 |
| Karolinska universitetssjukhuset - Huddinge | 1 (20) | 4 (80) | 0 (0) | 0 (0) | 5 |
| Karolinska universitetssjukhuset - Solna | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Löwet specialistmottagning | 0 (0) | 2 (50) | 0 (0) | 2 (50) | 4 |
| Norrtälje sjukhus | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Södersjukhuset | 5 (42) | 4 (33) | 3 (25) | 0 (0) | 12 |
| Södertälje sjukhus | 0 (0) | 0 (0) | 3 (75) | 1 (25) | 4 |
| Visby lasarett | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Privatläkare | 0 (0) | 6 (100) | 0 (0) | 0 (0) | 6 |
| Uppsala-Örebro | |||||
| Akademiska sjukhuset | 4 (57) | 3 (43) | 0 (0) | 0 (0) | 7 |
| Centralsjukhuset i Karlstad | 1 (7) | 12 (86) | 1 (7) | 0 (0) | 14 |
| Falu lasarett | 2 (67) | 1 (33) | 0 (0) | 0 (0) | 3 |
| Karlskoga lasarett | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Lindesbergs lasarett | 1 (100) | 0 (0) | 0 (0) | 0 (0) | 1 |
| Mora lasarett | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Mälarsjukhuset | 0 (0) | 4 (67) | 1 (17) | 1 (17) | 6 |
| Nyköpings lasarett | 0 (0) | 0 (0) | 3 (100) | 0 (0) | 3 |
| Sjukhuset i Arvika | 0 (0) | 0 (0) | 0 (0) | 1 (100) | 1 |
| Sjukhuset i Gävle | 1 (17) | 4 (67) | 0 (0) | 1 (17) | 6 |
| Sjukhuset i Torsby | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Universitetssjukhuset Örebro | 0 (0) | 6 (75) | 0 (0) | 2 (25) | 8 |
| Västmanlands sjukhus Västerås | 2 (12) | 11 (69) | 1 (6) | 2 (12) | 16 |
| Privatläkare | 0 (0) | 0 (0) | 0 (0) | 1 (100) | 1 |
| Sydöstra | |||||
| Höglandssjukhuset | 1 (20) | 4 (80) | 0 (0) | 0 (0) | 5 |
| Länssjukhuset i Kalmar | 0 (0) | 3 (50) | 1 (17) | 2 (33) | 6 |
| Länssjukhuset Ryhov | 0 (0) | 3 (75) | 0 (0) | 1 (25) | 4 |
| Oskarshamns sjukhus | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Universitetssjukhuset i Linköping | 0 (0) | 5 (56) | 0 (0) | 4 (44) | 9 |
| Vrinnevisjukhuset i Norrköping | 0 (0) | 5 (62) | 0 (0) | 3 (38) | 8 |
| Värnamo sjukhus | 0 (0) | 2 (40) | 0 (0) | 3 (60) | 5 |
| Västerviks sjukhus | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Privatläkare | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| |
Orchiektomi |
GnRH |
GnRH + AA kontinuerligt |
Endast AA |
Totalt |
| Södra | |||||
| Blekingesjukhuset - Karlshamn | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Blekingesjukhuset - Karlskrona | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Centrallasarettet Växjö | 0 (0) | 3 (60) | 0 (0) | 2 (40) | 5 |
| Centralsjukhuset Kristianstad | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Hallands sjukhus Halmstad | 0 (0) | 7 (100) | 0 (0) | 0 (0) | 7 |
| Helsingsborgs lasarett | 0 (0) | 0 (0) | 0 (0) | 1 (100) | 1 |
| Lasarettet i Ystad | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Lasarettet Trelleborg | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Ljungby lasarett | 0 (0) | 0 (0) | 0 (0) | 1 (100) | 1 |
| Skånes universitetssjukhus - Malmö | 0 (0) | 10 (100) | 0 (0) | 0 (0) | 10 |
| Ängelholms sjukhus | 0 (0) | 2 (40) | 0 (0) | 3 (60) | 5 |
| Privatläkare | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| Västra | |||||
| Alingsås lasarett | 0 (0) | 3 (100) | 0 (0) | 0 (0) | 3 |
| Hallands sjukhus Kungsbacka | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Kungälvs sjukhus | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Kärnsjukhuset i Skövde | 1 (33) | 2 (67) | 0 (0) | 0 (0) | 3 |
| Sahlgrenska Universitetssjukhuset | 0 (0) | 7 (78) | 1 (11) | 1 (11) | 9 |
| Sjukhuset i Lidköping | 1 (100) | 0 (0) | 0 (0) | 0 (0) | 1 |
| Specialistsjukvården Falkenberg | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Södra Älvsborgs Sjukhus - Skene | 0 (0) | 0 (0) | 2 (100) | 0 (0) | 2 |
| Uddevalla sjukhus | 1 (7) | 11 (79) | 0 (0) | 2 (14) | 14 |
| Privatläkare | 0 (0) | 5 (100) | 0 (0) | 0 (0) | 5 |
| Norra | |||||
| Kalix sjukhus | 0 (0) | 2 (100) | 0 (0) | 0 (0) | 2 |
| Lycksele lasarett | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Länssjukhuset i Sundsvall | 1 (9) | 10 (91) | 0 (0) | 0 (0) | 11 |
| Norrlands universitetssjukhus Umeå | 1 (25) | 3 (75) | 0 (0) | 0 (0) | 4 |
| Skellefteå lasarett | 1 (100) | 0 (0) | 0 (0) | 0 (0) | 1 |
| Sollefteå sjukhus | 3 (60) | 2 (40) | 0 (0) | 0 (0) | 5 |
| Sunderby sjukhus | 1 (33) | 1 (33) | 0 (0) | 1 (33) | 3 |
| Örnsköldsviks sjukhus | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 1 |
| Östersunds sjukhus | 0 (0) | 2 (67) | 0 (0) | 1 (33) | 3 |
| RIKET | |||||
| Totalt | 28 (10) | 188 (68) | 16 (6) | 43 (16) | 275 |
2 fick övrig hormonterapi och är därför exkluderade ur tabellen.
I figur 78 redovisas den kumulativa risken upp till 15 år efter diagnos för död i prostatacancer, hjärtkärlsjukdom och andra orsaker för fem riskkategorier av män som behandlats icke-kurativt. Skillnaden i risk för död i prostatacancer varierade från 9 % för män med lågrisktumör till 69 % för män med metastatisk sjukdom [19]. Ungefär 30 % av männen med högrisktumörer, oavsett ålder vid diagnos hade dött av cancern efter 10 år, vilket talar för att en större del av dessa män bör genomgå kurativ behandling än vad som nu sker.
2013; 18 publikationer
Van Hemelrijck M, Garmo H, Michaëlsson K, Thorstenson A, Stattin P, Holmberg L, Adolfsson J.
Mortality following Hip Fracture in Men with Prostate Cancer. PLoSOne 2013 Sep 27;8(9):e74492.
Vellekoop A, Loeb S, Folkvaljon Y, Stattin P. Population-Based Study of Predictors for Adverse
Pathology Among Candidates for Active Surveillance With Gleason 6 Prostate Cancer. J Urol,
Accepterad Sep 2013.
Bratt O, Carlsson S, Holmberg E, Holmberg L, Johansson E, Josefsson A, Nilsson A, Nyberg M,
Robinsson D, Sandberg J, Sandblom D, Stattin P. The Study of Active Monitoring in Sweden (SAMS):
A randomized study comparing two different follow-up schedules for active surveillance of low-risk
prostate cancer. Scand J Urol 2013 Oct; 47(5):347-55.
Stattin P, Stacy Loeb S. “To measure is to know. If you cannot measure it you cannot
improve it.“ Statistical modeling cannot compensate for unmeasured bias. Eur Urol July 2013.
Makarov D, Loeb S, Ulmert, D, Drevin L, Lambe M, Stattin P. Prostate Cancer imaging trends after
Nationwide effort to discourage inappropriate prostate cancer imaging. J Natl Cancer Inst 2013
Sep;105(17):1306-13.
Robinson D, Garmo H, Bill-Axelson A, Mucci L, Holmberg L, Stattin P. Use of 5α-reductase inhibitors
for lower urinary tract symptoms and risk of prostate cancer in Swedish men: nationwide,
population based case-control study. BMJ 2013 Jun 18;346:f3406. doi: 10.1136/bmj.f3406.
Nilsson H, Stranne J, Stattin P, Nordin P. Incidence of Groin Hernia Repair After Radical
Prostatectomy: A Population-Based Nationwide Study. Ann Surg. 2013 Jun 6.
Loeb S, Berglund A, Stattin P. Population-Based Study of Utilization and Determinants of Active
Surveillance and Watchful Waiting for Low- and Intermediate risk prostate cancer. J Urol 2013
Nov;190(5):1742-9.
Fall K, Garmo H, Gudbjörnsdottir S, Stattin P, Zethelius B. Diabetes Mellitus and Prostate Cancer
Risk; A Nationwide Case-Control Study within PCBaSe Sweden. Cancer Epidemiol Biomarkers
prev.2013 Jun;22(6):1102-1109.
Wirén SM, Drevin LI, Carlsson SV, Akre O, Holmberg EC, Robinson DE, Garmo HG, Stattin PE.
Fatherhood status and risk of prostate cancer: Nationwide, population-based case-control study. Int J
Cancer. 2013 Aug 15;133(4):937-43.
Van Hemelrijck M, Wigertz A, Sandin F, Garmo H, Hellstrom K, Fransson P, Widmark A, Lambe M,
Adolfsson J, Varenhorst E, Johansson JE, Stattin P. Cohort Profile: The National Prostate Cancer
Register of Sweden and Prostate Cancer data Base Sweden 2.0. Int J Epidemiol 2013 Aug;
42(4):956-67.
Lissbrant IF, Garmo H, Widmark A, Stattin P. Population-based study on use of chemotherapy
in men with castration resistant prostate cancer. Acta Oncol. 2013 Nov; 52(8):1593-601.
Eloranta S, Adolfsson J, Lambert PC, Stattin P, Akre O, Andersson TM, Dickman PW. How can
we make cancer survival statistics more useful for patients and clinicians: an illustration
using localized prostate cancer in Sweden. Cancer Causes & Control 2013 Mar;24(3):505-15.
Carlsson S, Sandin F, Fall K, Lambe M, Adolfsson J, Stattin P, Bill-Axelson A. Risk of suicide in men
with low-risk prostate cancer. Eur J Cancer 2013 May;49(7):1588-99.
Loeb S, Drevin L, Robinson D, Holmberg E, Carlsson S, Lambe M, Stattin P Risk of localized and
advanced prostate cancer among immigrants versus native-born Swedish men: a nation-wide
population-based study. Cancer Causes & Control 2013 Feb;24(2):383-90.
Van Hemelrijck M, Garmo H, Holmberg L, Bill-Axelson A, Akre O, Stattin P, Adolfsson J.
Thromboembolic events following surgery for prostate cancer. Eur Urol 2013 Feb; 63(2):354-63..
Stattin P, Sandin F, Hugosson J. Reply from Authors re: Urs E. Studer, Peter C. Albertsen. It’s Time
to Change the Treatment Paradigm for Prostate Cancer! Eur Urol 2013;63:97-9: PCBaSe Sweden
combines the National Prostate Cancer Register of Sweden with health care registers and
demographic databases: A useful tool for observational studies. Eur Urol 2013 Jan;63(1):99-100.
Rider J, Sandin F, Andrén O, Wiklund P, Hugosson J, Stattin. Long-term Outcomes Among
Non-Curatively Treated Men According to Prostate Cancer Risk Category in a Nation-wide,
Population-Based Study. Eur Urol 2013 Jan; 63(1):88-96.
2012; 9 publikationer
Wiren S, Stattin P. Research on quality registries provides clinical benefit. Results from the National
Prostate Cancer Register. Läkartidningen Juli 2012.
Van Hemelrijck M, Drevin L, Holmberg L, Garmo H, Adolfsson J, Stattin P. Primary cancers before
and after prostate cancer diagnosis. Cancer 2012 Dec; 118(24):6207-16.
Carlsson S, Bratt O, Stattin P, Egevad L. Current routines for transrectal ultrasound-guided prostate
biopsy: A web-based survey by the Swedish Urology Network. Scand J Urol Nephrol 2012 May 31.
Fridriksson J, Gunseus K, Stattin P. Information on pros and cons of prostate-specific antigen testing
to men prior to blood draw: A study from the National Prostate Cancer Register (NPCR) of Sweden.
Scand J Urol Nephrol 2012 Oct;46(5):326-31.
Grundmark B, Garmo H, Zethelius B, Stattin P, Lambe M, Holmberg L. Anti-androgen prescribing
patterns, patient treatment adherence and influencing factors; results from the nationwide PCBaSe
Sweden. Eur J Clin Pharmacol. 2012 Dec; 68(12):1619-30.
Thorstenson A, Bratt O, Akre O, Hellborg H, Holmberg L, Lambe M, Bill-Axelson A, Stattin
P, Adolfsson J. Incidence of fractures causing hospitalisation in prostate cancer patients:
Results from the population-based PCBaSe Sweden. Eur J Cancer. 2012;48(11):1672-81.
Jansson KF, Akre O, Garmo H, Bill-Axelson A, Adolfsson J, Stattin P, Bratt O. Concordance of
tumor differentiation among brothers with prostate cancer. Eur Urol. 2012 Oct;62(4);656-61.
Berglund A, Garmo H, Robinson D, Tishelman C, Holmberg L, Bratt O, Adolfsson J, Stattin P, Lambe
M. Differences according to socioeconomic status in the management and mortality in men with high
risk prostate cancer. Eur J Cancer. 2012;48(1):75-84.
Robinson D, Garmo H, Lindahl B, Van Hemelrijck M, Adolfsson J, Bratt O, Holmberg L, Stattin P.
Ischemic heart disease and stroke before and during endocrine treatment for prostate cancer in PCBaSe
Sweden. Int J Cancer. 2012;130(2):478-87.
2011; 5 publikationer
Van Hemelrijck M, Stattin P, Adolfsson J. Reply from Authors re: Matthew R. Cooperberg. Adverse
Effects of Androgen Deprivation and the Limits of National Tumor Registries. Eur Urol. 2011 Dec 9.
Van Hemelrijck M, Garmo H, Holmberg L, Stattin P, Adolfsson J. Multiple events of fractures and
cardiovascular and thromboembolic disease following prostate cancer diagnosis: results from the
population-based PCBaSe Sweden. Eur Urol. 2012;61(4):690-700.
Akre O, Garmo H, Adolfsson J, Lambe M, Bratt O, Stattin P . Mortality among men with locally
advanced prostate cancer managed with noncurative intent: a nationwide study in PCBaSe Sweden.
Eur Urol. 2011;60(3):554-63.
Bill-Axelson A, Garmo H, Nyberg U, Lambe M, Bratt O, Stattin P, Adolfsson J, Steineck G.
Psychiatric treatment in men with prostate cancer–results from a Nation-wide, population-based
cohort study from PCBaSe Sweden. Eur J Cancer. 2011;47(14):2195-201.
Berglund A, Garmo H, Tishelman C, Holmberg L, Stattin P, Lambe M. Comorbidity, treatment and
mortality: a population based cohort study of prostate cancer in PCBaSe Sweden. J Urol.
2011;185(3):833-9.
2010; 8 publikationer
Bratt O, Garmo H, Adolfsson J, Bill-Axelson A, Holmberg L, Lambe M, Stattin P. Effects of
prostate-specific antigen testing on familial prostate cancer risk estimates. J Natl Cancer Inst.
2010;102(17):1336-43.
Holmstrom B, Holmberg E, Egevad L, Adolfsson J, Johansson JE, Hugosson J, Stattin P, National
Prostate Cancer Register of Sweden. Outcome of primary versus deferred radical prostatectomy in the
National Prostate Cancer Register of Sweden Follow-Up Study. J Urol. 2010;184(4):1322-7.
Stattin P, Garmo H, Steineck G, Bill-Axelson A. Re: Immediate risk of suicide and cardiovascular
death after a prostate cancer diagnosis: cohort study in the United States. J Natl Cancer Inst.
2010;102(18):1447-8; author reply 8. 1448.
Bratt O, Berglund A, Adolfsson J, Johansson JE, Tornblom M, Stattin P. Prostate cancer diagnosed
after prostate-specific antigen testing of men without clinical signs of the disease: a population-based
study from the National Prostate Cancer Register of Sweden. Scand J Urol Nephrol. 2010;44(6):384-90.
Van Hemelrijck M, Garmo H, Holmberg L, Ingelsson E, Bratt O, Bill-Axelson A, Lambe M, Stattin P,
Adolfsson J. Absolute and relative risk of cardiovascular disease in men with prostate cancer:
results from the Population-Based PCBaSe Sweden. J Clin Oncol. 2010;28(21):3448-56.
Stattin P, Holmberg E, Johansson JE, Holmberg L, Adolfsson J, Hugosson J, National Prostate Cancer
Register (NPCR). Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden
follow-up study. J Natl Cancer Inst. 2010;102(13):950-8.
Van Hemelrijck M, Adolfsson J, Garmo H, Bill-Axelson A, Bratt O, Ingelsson E, Lambe M, Stattin P,
Holmberg L. Risk of thromboembolic diseases in men with prostate cancer: results from the
population-based PCBaSe Sweden. Lancet Oncol. 2010;11(5):450-8.
Bill-Axelson A, Garmo H, Lambe M, Bratt O, Adolfsson J, Nyberg U, Steineck G, Stattin P.
Suicide risk in men with prostate-specific antigen-detected early prostate cancer: a nationwide
population-based cohort study from PCBaSe Sweden. Eur Urol. 2010;57(3):390-5.
2009; 4 publikationer
Holmberg L, Adolfsson J, Mucci L, Garmo H, Adami HO, Möller H, Johansson JE, Stampfer M.
Season of diagnosis and prognosis in breast and prostate cancer. Cancer Causes Control 2009 Jul;
20(5): 663-70.
Andrèn O, Garmo H, Mucci L, Andersson S-O, Johansson J-E, Fall K. Incidence and mortality of
incidental prostate cancer: a Swedish register-based study. Br J Cancer. 2009 Jan 13;100 (1):170-3.
Hagel E, Garmo H, Bill-Axelson A, Bratt O, Johansson JE, Adolfsson J, Lambe M, Stattin P. PCBaSe
Sweden: a register-based resource for prostate cancer research. Scand J Urol Nephrol 2009; 43(5):
342-9.
Carlsson S, Adolfsson J, Bratt O, Johansson JE, Ahlstrand C, Holmberg E, Stattin P, Hugosson J.
Nationwide population-based study on 30-day mortality after radical prostatectomy in Sweden. Scand
J UrolNephrol 2009; 43(5): 350-6.
Accepterade/submittade manuskript baserade på NPCR
Stattin P, Carlsson S, Holmström B, Vickers A, Hugosson J, Lilja H, Jonsson H. Prostate Cancer
Mortality in Areas with High and Low Prostate Cancer Incidence. Accepted pending revision.
Fridriksson J, Holmberg E, Bratt O, Garmo H, Adolfsson J, Lambe M, Bill-Axelson A, Stattin P.
Readmission after radical prostatectomy. Nation-wide, population-based study in PCBaSe Sweden.
Submitted.
Ohmann EL, Loeb S, Robinsson D, Bill-Axelson A, Berglund A, Stattin P. Nationwide
Population-based Study of Prostate Cancer Stage Migration Between and Within Clinical Risk
Categories. Submitted.
Lundström KJ, Drewin L, Carlsson S, Garmo H, Loeb S, Stattin P, Bill-Axelson A. Risk factors for
infections after transrectal ultrasound guided prostate biopsy-a population based study. Submitted.
Tomic K, Berglund A, Robinson D, Hjälm-Eriksson M, Carlsson S, Lambe M, Stattin P. Comorbidity,
management, and mortality in prostate cancer cases not registered in a quality register. Submitted.
Plym A, Folkvaljon Y, Holmberg L, Johansson E, Fransson P, Stattin P, Lambe M. Drug prescription
for erectile dysfunction before and after diagnosis of localized prostate cancer. Submitted.
Carlsson S, Drevin L, Widmark A, Lissbrant IF, Robinson D, Johansson E, Stattin P, Fransson P.
Long-term local adverse effects of prostate cancer treatment – Results from a population-based study.
Submitted.
American Urological Association, 3-4 maj San Diego
Incidence-based Prostate Cancer Mortality in Areas with High and Low Prostate Cancer Incidence. Pär Stattin och Sigrid Carlsson. Best poster in session award
Population-Based Study of Utilization and Determinants of Active Surveillance and Watchful Waiting for Low- and Intermediate prostate cancer. Stacy Loeb.
Prostate Cancer imaging trends after Nationwide effort to discourage inappropriate prostate cancer imaging. Dan Makarov.
Use of 5α-reductase inhibitors for lower urinary tract symptoms and risk of prostate cancer in Swedish men: nationwide, population based case-control study. David Robinson.
Risk of suicide in men with low-risk prostate cancer. Sigrid Carlsson.
Nordiska cancerregistermötet, 13-14 juni Reykjavik
Readmission after radical prostatectomy. Nation-wide, population-based study in PCBaSe Sweden. Jon Fridriksson.
Comorbidity, management, and mortality in prostate cancer cases not registered in a quality register. Katarina Tomic.
Kirurgveckan, 19-23 augusti Uppsala
Samkörning av kvalitetsregister med andra sjukvårdsregister och demografiska databaser. Pär Stattin.
Urologidagarna, 3-4 oktober Linköping
Onlinerapport i realtid från NPCR. Pär Stattin, Lena Damber, Erik Holmberg, Fredrik Sandin, Håkan Cederberg, Mats Lambe.
Comorbidity, management, and mortality in prostate cancer cases not registered in a quality register. Katarina Tomic.
Kvalitetsregisterdagarna, 9-10 oktober Stockholm
Onlinerapport i realtid från NPCR. Pär Stattin, Lena Damber, Erik Holmberg, Fredrik Sandin, Håkan Cederberg, Mats Lambe
Kontrollerad delning av registerdata. Pär Stattin och Christoffer Lagerros.
Readmission after radical prostatectomy. Nation-wide, population-based study in PCBaSe Sweden. Jon Fridriksson.
Chefläkarmötet i urologi, november Örebro
Onlinerapport i realtid från NPCR Pär Stattin
[1] Socialstyrelsen. Väntetider i cancervården – väntetider från remiss till behandling i cancervården – delrapport oktober 2013.
[2] Mohler J, Bahnson RR, Boston B, Busby JE, D’Amico A, Eastham JA, et al. NCCN clinical practice guidelines in oncology: prostate cancer. J Natl Compr Canc Netw. 2010 Feb;8(2):162-200.
[3] Stattin P, Sandin F, Ahlgren G, Bratt O, Damber JE, Hugosson J, et al. Nation-wide population-based study on 15-year mortality in prostate cancer according to risk categories in the National Prostate Cancer Register (NPCR) of Sweden. EAU conference, abstract 1050, Eur Urol suppl Wien 2011.
[4] Socialstyrelsen. Nationella riktlinjer för prostatcancersjukvård. 2007.
[5] Socialstyrelsen. Nationella riktlinjer för bröst -, kolorektal och prostatacancer - tabellbilaga till beslutstödsdokument. 2007.
[6] Fridriksson J, Gunseus K, Stattin P. Information on pros and cons of prostate-specific antigen testing to men prior to blood draw: A study from the National Prostate Cancer Register (NPCR) of Sweden. Scand J Urol Nephrol. 2012 Oct;46(5):326-31.
[7] Carlsson S, Bratt O, Stattin P, Egevad L. Current routines for transrectal ultrasound-guided prostate biopsy: a web-based survey by the Swedish Urology Network (SUNe). Scand J Urol Nephrol 2012.
[8] Widmark A, Klepp O, Solberg A, Damber JE, Angelsen A, Fransson P, et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet. 2009 Jan 24;373(9660):301-8.
[9] Stattin P, Holmberg E, Bratt O, Adolfsson J, Johansson JE, Hugosson J. Surveillance and deferred treatment for localized prostate cancer. Population based study in the National Prostate Cancer Register of Sweden. J Urol. 2008 Dec;180(6):2423-9.
[10] Sammon J, Trinh QD, Menon M. Robotic radical prostatectomy: a critical analysis of surgical quality. Curr Opin Urol. 2011 May;21(3):195-9.
[11] Bolla M, van Poppel H, Collette L, van Cangh P, Vekemans K, Da Pozzo L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet. 2005 Aug 13-19;366(9485):572-8.
[12] Thompson IM, Tangen CM, Paradelo J, Lucia MS, Miller G, Troyer D, et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol. 2009 Mar;181(3):956-62.
[13] Wiegel T, Bottke D, Steiner U, Siegmann A, Golz R, Storkel S, et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol. 2009 Jun 20;27(18):2924-30.
[14] Robinson D, Garmo H, Lindahl B, Van Hemelrijck M, Adolfsson J, Bratt O, et al. Ischemic heart disease and stroke before and during endocrine treatment for prostate cancer in PCBaSe Sweden. Int J Cancer. 2012 Jan 15;130(2):478-87.
[15] Thorstenson A, Bratt O, Akre O, Hellborg H, Holmberg L, Lambe M, et al. Incidence of fractures causing hospitalisation in prostate cancer patients: results from the population-based PCBaSe Sweden. Eur J Cancer. 2012 Jul;48(11):1672-81.
[16] Van Hemelrijck M, Adolfsson J, Garmo H, Bill-Axelson A, Bratt O, Ingelsson E, et al. Risk of thromboembolic diseases in men with prostate cancer: results from the population-based PCBaSe Sweden. Lancet Oncol. 2010 May;11(5):450-8.
[17] Van Hemelrijck M, Garmo H, Holmberg L, Ingelsson E, Bratt O, Bill-Axelson A, et al. Absolute and relative risk of cardiovascular disease in men with prostate cancer: results from the Population-Based PCBaSe Sweden. J Clin Oncol. 2010 Jul 20;28(21):3448-56.
[19] Rider JR, Sandin F, Andren O, Wiklund P, Hugosson J, Stattin P. Long-term Outcomes Among Noncuratively Treated Men According to Prostate Cancer Risk Category in a Nationwide, Population-based Study. Eur Urol. 2012 Aug 10.